Het was een kleine studie, maar kleine studies die door de juiste mensen worden uitgevoerd, kunnen een groot verschil maken. Bovendien gaat er niets boven echt graven in de hersenen – en hier was echt graafwerk voor nodig – om te weten te komen wat het SARS-CoV-2-virus doet met dit meest obscure en moeilijk toegankelijke orgaan.
in de hersenen van long COVID-patiënten kunnen aanwakkeren.
In zekere zin is de hoofdauteur van deze studie, Avindra Nath, er al eens geweest. Anderhalf jaar geleden, in februari 2021, kwam Nath met een van de eerste – en nog steeds de meest interessante – hersenbevindingen bij COVID. De studie “Microvascular Injury in the Brains of Patients with Covid-19” [Microvasculair letsel in de hersenen van patiënten met Covid-19] belichtte een thema – schade aan kleine bloedvaten – dat in de loop van de tijd alleen maar is gegroeid. Naths vroege studie vond wijdverspreide puntvormige hyperintensiteiten – vergelijkbaar met wat tientallen jaren geleden werd gevonden bij ME/cvs – en kleine bloedvatbeschadigingen en lekkage in de hersenen.
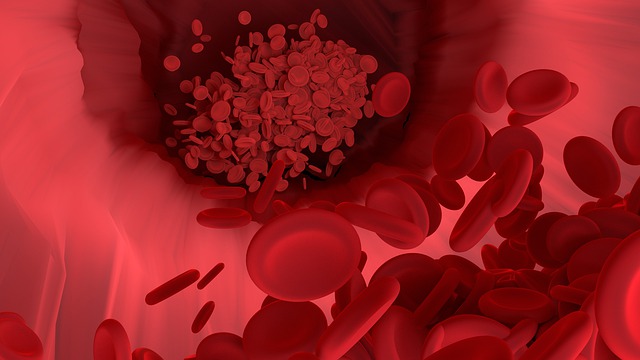
Eiwitten zoals fibrinogeen, C1q, IgG en IgM – die alleen in het bloed mogen worden aangetroffen – waren in de hersenen gelekt, hetgeen ongetwijfeld een immuunreactie teweeg had gebracht. De resultaten van de studie wijzen erop dat de bloed-hersenbarrière die de hersenen beschermt, beschadigd is.
Bij een recent onderzoek van de literatuur over langdurige/long COVID werden niet minder dan 15 studies gevonden waarin problemen met bloedvaten en bloedstolling bij COVID aan de orde kwamen. Geen van deze studies had echter betrekking op problemen met de bloedvaten in de hersenen.
In “Neurovascular injury with complement activation and inflammation in COVID-19” [Neurovasculair letsel met complementactivatie en ontsteking in COVID-19], was Nath terug met een meer gedetailleerde autopsiestudie die ons veel meer vertelt over wat dit virus kan doen. Het virus toonde in deze studie echt zijn potentieel dodelijke karakter: alle deelnemers aan deze studie stierven vrij snel nadat ze geïnfecteerd waren geraakt en, terwijl ze wel ademhalingssymptomen kregen, deed het virus zijn dodelijke werk in hun hersenen. Hoewel de deelnemers aan de studie zijn overleden, verklaarde Nath in interviews dat hij van mening is dat de bevindingen van de studie van nut kunnen zijn voor wat er bij long COVID gebeurt.
De studie onderzocht de endotheelcellen die de bloedvaten bekleden, grondig. De door antilichamen geproduceerde immuuncomplexen die op de endotheelcellen werden aangetroffen, wezen erop dat er een afweerreactie had plaatsgevonden. IgG- en IgM-antilichamen en bloedplaatjesaggregaten (d.w.z. kleine bloedklonters) werden geassocieerd met eiwitten (C1q, C4d, en C5b-9) die geproduceerd worden door het klassieke reactiepad van de complementaire tak van het immuunsysteem. Activering van het klassieke reactiepad komt voor bij veel auto-immuunziekten en ontstekingsziekten.
Verhoogde niveaus van een adhesiereceptor op de oppervlakken van deze cellen suggereerden dat de beschadigde cellen geactiveerde bloedplaatjes aantrokken. Deze veroorzaakten een stollingscascade die de endotheelcellen beschadigde, waardoor deze gingen lekken. (Genexpressiegegevens wezen erop dat een stollingscascade was begonnen en dat een stolling had plaatsgevonden.) Verhoogde niveaus van de von Willebrandfactor, die geassocieerd wordt met schade aan de endotheelcellen die de bloedvaten bekleden, bevestigden verder het feit dat er schade aan de bloedvaten was opgetreden.
De auteurs merkten op dat studies naar COVID-19 van de longen gelijkaardige “vreemde” bloedvatbevindingen hebben gevonden met inbegrip van “unieke vasculaire kenmerken bestaande uit endotheelschade, microtrombose (microbloedklonters) en intussusceptie angiogenese (‘splijtende bloedvaten’)”.
Het allerbelangrijkste antigeen – de molecule die op de endotheelcellen wordt aangetroffen – dat het immuunsysteem ertoe had aangezet hen aan te vallen, blijft onbekend, maar de auteurs opperden dat het ofwel van het spike-eiwit van het coronavirus zou kunnen komen, ofwel van de ACE-2 -receptor die het virus gebruikt om in de cellen door te dringen. Gezien de abnormale bevindingen m.b.t. ACE-2 bij ME/cvs, zou dit laatste waarschijnlijk meer van nut zijn voor mensen met ME/cvs.
Een ontstekingsreactie waarbij vooral de macrofagen in de ruimten rond de bloedvaten betrokken zijn, weerspiegelt een poging om de schade te herstellen die door de lekkende bloedvaten is veroorzaakt. Daarmee heb je een aanhoudend ontstekingsproces in de hersenen.
Met name in het gebied van de hersenstam werden wijdverbreide neuronverliezen en beschadigingen geconstateerd. Hoewel de studie daar geen bewijs van infectie vond, merkten zij op dat “betrokkenheid van de hersenstam ernstige gevolgen zou kunnen hebben aangezien vele vitale functies door dit gebied worden gecontroleerd” en dat “vijf patiënten in onze studie plotseling stierven, de meesten tijdens hun slaap”. De hersenstam is natuurlijk van groot belang bij ME/cvs.
Het model
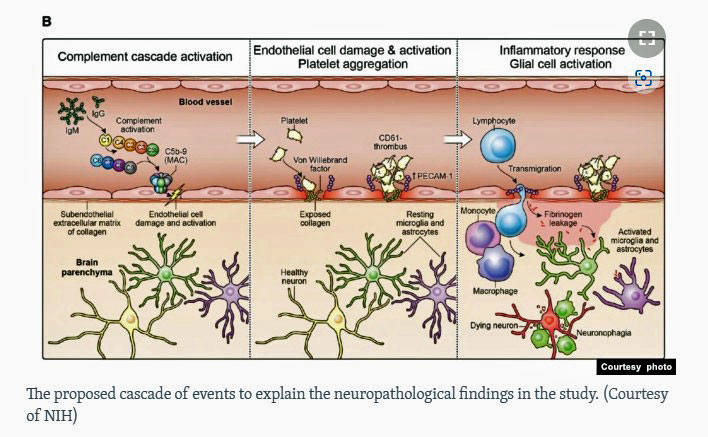
De auteurs denken dat het volgende is gebeurd: Het virus triggert – op een manier die zij nog niet kennen – de complementroute om immuunantilichaamcomplexen te vormen die de endotheelcellen aanvallen en activeren. De geactiveerde endotheelcellen zorgen vervolgens voor de vorming van ontstekingsbevorderende en stollingsbevorderende factoren, waardoor zich stolsels vormen. Door de beschadigde endotheelcellen konden proteïnen weglekken in de ruimten rond de bloedvaten.
De ongewenste proteïnen trekken dan monocyten aan – die macrofagen worden – die de proteïnen opslokken in een poging om het gebied schoon te maken. Sommige proteïnen vonden echter hun weg naar de immuuncellen in de hersenen – de gliacellen – en ook naar de neuronen die zij omgeven en ondersteunen. De gliacellen voelen een indringer en vallen de proteïnen aan, maar beschadigen daarbij de neuronen, waardoor de macrofagen ook deze moeten opruimen.
De plekken met lekkende bloedvaten in de hersenen liggen verspreid over de hersenen, maar zijn blijkbaar meer geconcentreerd in het gebied van de achterkant van de hersenen, waar de hersenstam zich bevindt, en veroorzaken een voortdurende ontstekingsreactie in de hersenen en schade aan de zenuwen. De symptomen die elke persoon ervaart, hangen af van in welk deel van de hersenen de bloedvatlekkage zich voordoet.
Verband met long COVID?
De deelnemers aan deze studie waren overleden, maar het gebrek aan betrokkenheid van de longen en de enorme impact op hun hersenen, deden Nath denken aan long COVID. Als deze patiënten het overleefd hadden, zouden ze volgens Nath waarschijnlijk long COVID-patiënten geworden zijn, en verklaarde: “Het is heel goed mogelijk dat deze zelfde immuunrespons persisteert bij long COVID-patiënten, met neuronale schade als gevolg.”
Nath merkte op dat immuunmodulerende therapieën zouden kunnen helpen de immuunactivatie uit te schakelen die zoveel problemen veroorzaakt, “deze bevindingen hebben zeer belangrijke therapeutische implicaties”. Nath is begonnen met een studie naar IVIG/corticosteroïden bij 40 personen.
Verband met ME/cvs?
Dit model is des te interessanter omdat het lijkt te passen bij wat sommige ME/cvs-studies in het verleden hebben gevonden. Baraniuks studie uit 2005 naar het cerebrospinaal proteoom vond bewijs van amyloïde (verkeerd gevouwen eiwit) afzetting in de bloedvaten en een verzwakking van de bloedvatwanden in de hersenen. Baraniuk speculeerde dat gelokaliseerde bloedingen, veroorzaakt door amyloïde afzetting in de bloedvaten, zich zouden kunnen voordoen in de hersenen van ME/cvs-patiënten.
In 1992 werd in een grote studie, gezamenlijk geschreven door Dr. Peterson, Dr. Cheney, Dr. Komaroff, en Dr. Paul Gallo, wijdverspreide puntvormige hyperintensiteiten gevonden in de hersenen van mensen met ME/cvs. De auteurs verklaarden dat deze puntvormige hyperintensiteiten overeenkwamen met de perivasculaire ruimten die het hersenvocht omgeven en suggereerden dat een gelijkaardig proces had plaatsgevonden: lekkage had een ontstekingsreactie in de hersenen in gang gezet die de neuronen beschadigde. Net als bij Naths bevindingen, varieerde de plaats van de hyperintensiteiten per patiënt. Er wordt nu aangenomen dat de hyperintensiteiten veroorzaakt worden door microvasculaire aandoeningen, d.w.z. beschadiging van de kleine bloedvaten in de hersenen – precies wat Nath heeft gevonden.
Belangrijk onderzoeksgebied
Met meer dan een dozijn studies over endotheelcellen, bloedvaten en stollingen die opduiken bij long COVID, en soortgelijke studies die opduiken bij ME/cvs, zijn de bloedvaten en het bloed zelf gebieden van intense belangstelling geworden.
De hoofdpunten
- Nath was niet in staat te bepalen wat het immuunsysteem tot deze cellen had aangetrokken, maar stelde dat ofwel het spike-eiwit van het coronavirus, ofwel schade aan de ACE-II-receptor die het virus gebruikt om de cellen binnen te dringen, daarvoor verantwoordelijk zou kunnen zijn. (Een paar studies suggereren dat schade aan de ACE-II-receptor is opgetreden bij ME/cvs en POTS).
- De schade aan de endotheelcellen zorgde ervoor dat ze geactiveerd werden en meer immuunfactoren produceerden – inclusief het aantrekken van bloedplaatjes naar het gebied en het in gang zetten van een stollingscascade.
- De kleine bloedklonters die zich vormden, blijken de hechte verbindingen van de endotheelcellen die de bloedvaten bekleden, te hebben verbroken – waardoor eiwitten in de perivasculaire ruimten rond de bloedvaten terechtkwamen.
- Deze proteïnen, en de immuunrespons die ze teweegbrachten in de microgliacellen, veroorzaakten vervolgens een voortdurende ontsteking.
- Het gebrek aan betrokkenheid van de longen en de hoge graad van herseninflammatie bij deze patiënten – van wie de meesten stierven zonder ooit in een ziekenhuis te zijn geweest – bracht Nath tot de stelling dat als deze patiënten hadden overleefd, zij waarschijnlijk long COVID zouden hebben gekregen.
- Een gelijkaardig proces kan zich voordoen bij ME/cvs. Dertig jaar geleden vond een ME/cvs-studie wijdverspreide niveaus van “puntvormige hyperintensiteiten” bij ME/cvs-patiënten waarvan wordt verondersteld dat ze de disfunctie van kleine bloedvaten weerspiegelen. Zeven jaar geleden wees James Baraniuks proteoomstudie in cerebrale spinale vloeistof op de afzetting van amyloïde eiwitten in endotheelcellen, verzwakte hersenbloedvatwanden, en lekkage in de hersenen.
- Nath suggereerde dat behandeling om het immuunsysteem te remmen nuttig zou kunnen zijn bij long COVID en is begonnen met een studie naar IVIG bij 40 personen met long COVID.
- Dit is een belangrijk onderzoeksgebied! Meer blogs over de werking van kleine bloedvaten bij long COVID en ME/cvs komen eraan.
© Health Rising, 16 juli 2022. Vertaling ME/cvs Vereniging, redactie ME-gids.







