De kernpunten
- De tweede van een serie blogs over recente bevindingen betreffende de mitochondriën bij het chronischevermoeidheidssyndroom (ME/cvs), langdurige COVID en fibromyalgie legt de nadruk op ME/cvs.
- De eerste mitochondriale ME/cvs-studie op de agenda is “slechts” een casusverslag – maar wat voor een! De hoofdauteur van de paper was niemand minder dan Alan Light, en dat verdient een kleine uitweiding.
- Light probeerde hetzelfde te doen voor vermoeidheid als voor pijn, namelijk de paden van vermoeidheid in kaart te brengen die tijdens het sporten ontstaan. Alan en Kathleen Light waren pioniers in een reeks studies in de jaren 2010 die aantoonden dat de witte bloedcellen van ME/cvs-patiënten een overreactie vertoonden op metabolieten die vrijkwamen in het bloed tijdens inspanning.
- De Lights toonden verder aan dat de reactie op inspanning bij ME/cvs en een andere vermoeidheidsstoornis vergelijkbaar en verschillend was: beide ziekten vertoonden een ontregeling van het vecht-of-vlucht-systeem of sympathische zenuwstelsel, maar alleen de witte bloedcellen van ME/cvs-patiënten gingen in een soort razernij op zoek naar tekenen dat de spieren beschadigd waren.
- De Lights namen ook deel aan een baanbrekend erfelijkheidsonderzoek in 2011 dat concludeerde: a) dat er een sterke erfelijke factor was bij ME/cvs (d.w.z. ME/cvs kan in families voorkomen), b) dat er een groep “hoog-risico” familielijnen bestond (die bestudeerd zouden moeten worden). Maar de NIH weigerde nogal bizar om er verdere financiering voor te verstrekken.
- Na ongeveer 10 jaar gestaag werken aan ME/cvs, was de laatste ME/cvs-publicatie van de Lights in 2017. In 2024 dook Alan Light op in een intrigerend casusonderzoek naar een 75-jarige vrouw die al meer dan 20 jaar ziek was na een epstein-barrinfectie.
- Een diepgravende duik in haar mitochondriaal DNA en haar mitochondriën onthulde echter dat ze verschillende mitochondriale DNA-mutaties had. De auteurs geloofden dat deze mutaties desastreus zouden zijn en “progressieve effecten op de ATP-productie en mitochondriale functies” zouden hebben.
- Ze geloofden dat de herpesvirusinfectie de mutaties veroorzaakte door grote aantallen reactieve zuurstofsoorten (vrije radicalen) te produceren die de toch al verzwakte mitochondriën niet aankonden.
- Hoewel we normaal gesproken niet aan mitochondriën denken als onderdeel van de immuunafweer, spelen ze een belangrijke rol bij het slaan van alarm als ziekteverwekkers de kop opsteken. Als reactie hierop produceren virussen grote aantallen “virologs” in een poging om de mitochondriën uit te schakelen en de immuunrespons af te remmen.
- Vervolgens werd in een recent diermodel onderzocht hoe vermoeidheid in de hersenen of “centrale vermoeidheid” de mitochondriën beïnvloedt. Het idee dat centrale vermoeidheid een grote rol zou kunnen spelen is logisch omdat ME/cvs-symptomen lijken op de griepachtige symptomen die door de hersenen worden geproduceerd wanneer we een verkoudheid krijgen.
- Het onderzoek, dat muizen onder stress zette maar ze niet harder liet trainen, ontdekte dat de stress de mitochondriën zowel in de hersenen als in de spieren op verschillende manieren beschadigde. Dat suggereerde dat veranderingen in de hersenen de mitochondriën in de spieren (!) konden beïnvloeden.
- De auteurs stelden dat de vermoeidheid, het verminderde uithoudingsvermogen en de cognitieve problemen die gevonden werden bij de muizen met centrale vermoeidheid, verband hielden met mitochondriale schade, problemen met het energiemetabolisme en oxidatieve stress. Wederom geloofden ze dat mitochondriale schade een sleutelrol speelde bij het veroorzaken van deze symptomen.
- Tot slot bleek uit een zeer klein maar misschien veelzeggend onderzoek van Stanford dat stimulering van de T-cellen van ME/cvs-patiënten resulteerde in een verhoogd aantal dode en stervende T-cellen. Zij dachten dat dit mogelijk het gevolg was van beschadigde mitochondriën die de “hitte niet aankonden” toen ze de opdracht kregen geactiveerd te worden.
- En weer waren we terug bij de mitochondriën. Of het nu gaat om de hersenen, de spieren of de immuuncellen, deze onderzoeken – allemaal klein, moet worden vermeld – brachten ons terug bij wat heel goed de oerzonde in deze ziekten zou kunnen zijn: disfunctionele mitochondriën.
De tweede van een serie blogs over recente bevindingen betreffende de mitochondriën bij het chronischevermoeidheidssyndroom (ME/cvs), langdurige COVID en fibromyalgie legt de nadruk op ME/cvs.
Lees ook: The Mitochondria in Long COVID Pt. I: Are Core Problems Being Uncovered?
De eerste mitochondriale ME/cvs-studie op de agenda is “slechts” een casusverslag – maar wat voor een! De hoofdauteur van de paper was niemand minder dan Alan Light, en dat verdient een kleine uitweiding.

Alan Light is terug!
We kunnen niet zomaar voorbijgaan aan het feit dat Alan Light opnieuw over ME/cvs heeft gepubliceerd. Voor wie hen niet herkent, hij en zijn vrouw, Kathleen Light, zijn onderzoekers naar pijn aan de Universiteit van Utah die van 2009 tot ongeveer 2017 een reeks veelbelovende studies naar ME/cvs hebben geproduceerd.
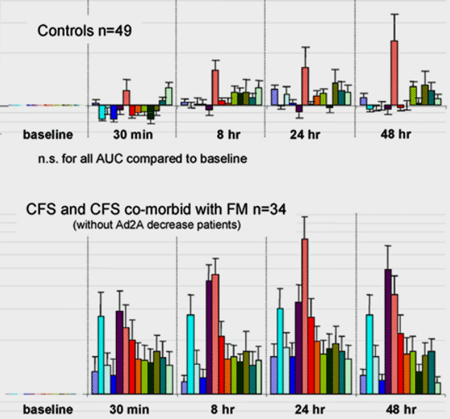
Hun publicatie uit 2012 produceerde misschien wel de meest opzienbarende grafiek die ik tot nu toe heb gezien op het gebied van ME/cvs. Ze liet zien dat lichaamsbeweging een opmerkelijke toename veroorzaakte in de expressie van receptoren op witte bloedcellen die metabolieten detecteren geassocieerd met lichaamsbeweging. In wezen suggereerde ze dat lichaamsbeweging ofwel veel schade veroorzaakte waar de witte bloedcellen op reageerden, en/of dat de witte bloedcellen overgevoelig waren geworden voor tekenen van schade door lichaamsinspanning. (Lichaamsinspanning veroorzaakt altijd een vorm van schade). In beide gevallen leek het erop dat een door inspanning veroorzaakte immuunactivering in volle ontplooiing was.
Opvallend is dat, gezien Naviaux’ nadruk op purinerge metabolieten, de publicatie met name de activering van een purinerge receptor (purinerge type 2X4 receptor) eruit pikte. De studie toonde ook aan dat mensen met ME/cvs en een andere beruchte vermoeiende ziekte, multiple sclerose (MS), gelijkaardig en verschillend waren als het op lichamelijke inspanning aankwam.
Lichamelijke inspanning stimuleerde bij MS de witte bloedcellen niet om alarm te slaan voor door inspanning veroorzaakte metabolieten, maar het veroorzaakte wel een piek in adrenerge receptoractiviteit bij zowel ME/cvs- als bij MS-patiënten (maar niet bij gezonde controles). Dat suggereerde dat lichaamsbeweging bij beide ziekten het sympathische zenuwstelsel ontregelde.
De spiervermoeidheidstrajecten ontrafelen
Alan Light zei dat hij voor vermoeidheid wilde doen wat voor pijn was gedaan (d.w.z. de vermoeidheidstrajecten in het lichaam verhelderen) en in 2015 bundelden hij en Markus Amann hun bevindingen in een overzichtspaper, “From Petri dish to human: new insights into the mechanisms mediating muscle pain and fatigue, with implications for health and disease” (Van petrischaal tot mens: nieuwe inzichten in de mechanismen die spierpijn en vermoeidheid beïnvloeden, met implicaties voor gezondheid en ziekte).
Het artikel stelde dat metabolieten die worden geproduceerd door spieractiviteit, zowel gemyeliniseerde als ongemyeliniseerde neuronen (dunne zenuwvezels) activeren. Vervolgens sturen deze zenuwvezels signalen naar het centrale zenuwstelsel via de zenuw in de achterhoorn van het ruggenmerg.
Ze merkten op dat er twee sets van receptoren aanwezig waren die ontwikkeld zijn om te reageren op deze door inspanning veroorzaakte metabolieten: het ene subtype reageerde op relatief lage niveaus van intramusculaire metabolieten (lactaat, ATP en protonen), zoals waargenomen tijdens ‘normale’ (d.w.z. vrij doorbloede en aerobe) inspanning, terwijl het andere subtype reageerde op hogere concentraties van metabolieten die geproduceerd werden tijdens ischemische omstandigheden waarin de spier zich in een staat van hypoxie bevond; d.w.z. met een laag zuurstofniveau.
In de loop der tijd concludeerden studies dat protonen, ATP en lactaat die door de spieren worden geproduceerd spiervermoeidheid en pijn uitlokken, en dat neuronen met ASIC-, P2X- en TRPV1-receptoren hierop reageren. The Lights ontdekten dat lichamelijke inspanning deze receptoren sterk opwaarts reguleerde bij ME/cvs. Daarmee leken ze op weg om te bepalen hoe spieractiviteit tijdens inspanning de pijn en vermoeidheid bij ME/cvs zou kunnen veroorzaken, maar de tijd van de Lights met ME/cvs eindigde in 2017 met het artikel van Dane Cook waaruit bleek dat inspanning de werking van de hersenen beïnvloedde.
Disfunctie overerven (bij de NIH)? De erfelijkheidsstudie
De Lights werkten ook mee aan een publicatie uit 2011, “Evidence for a heritable predisposition to Chronic Fatigue Syndrome” [Bewijs voor een erfelijke voorbeschiktheid voor het chronischevermoeidheidssyndroom], die opmerkelijk was vanwege: a) de conclusie dat er “sterke steun was voor een erfelijke bijdrage” aan ME/cvs (d.w.z. ME/cvs kan in families voorkomen), b) de mogelijkheid om een groep “hoog-risico” familielijnen te identificeren, en c) het bizarre feit dat dit nooit werd opgevolgd (ze probeerden het wel).

Het identificeren van hoog-risico familielijnen was een succes, omdat onderzoekers meestal families bestuderen om aanwijzingen te krijgen over wat er aan de hand is bij een ziekte. Het bizarre is dat de NIH een succesvolle studie financierde en vervolgens niet bereid was om een vervolgstudie te financieren. (Waarom de studie dan überhaupt financieren?)
Wat er gebeurde om de ME/cvs-kraan bij de Lights uit te zetten, is onduidelijk, maar het artikel uit 2017 was het laatste van de Lights over ME/cvs tot in 2024, toen Alan Light opdook in een interessant casusverslag.
Een verband tussen virussen en mitochondriën?
Het casusverslag, “Mitochondrial DNA Missense Mutations ChrMT: 8981A > G and ChrMT: 6268C > T Identified in a Caucasian Female with Myalgic Encephalomyelitis/Chronic Fatigue Syndrome (ME/CFS) Triggered by the Epstein–Barr Virus” [De ‘mitochondriale DNA missense mutaties ChrMT: 8981A > G en ChrMT: 6268C > T geïdentificeerd in een Kaukasische vrouw met myalgische encefalomyelitis/chronischevermoeidheidssyndroom (ME/cvs) getriggerd door het epstein-barrvirus], betreft een 75-jarige vrouw die ME/cvs had ontwikkeld, getriggerd door een infectie met infectieuze mononucleose ongeveer 20 jaar eerder.
Haar symptomen waren voornamelijk neurologische en cognitieve stoornissen en bestonden uit vermoeidheid, ernstige PEM, ernstige dysautonomie, niet-verkwikkende slaap, wijdverspreide pijn en gevoeligheid, sporadische duizeligheid met draaierigheid, ernstige orthostatische intolerantie en hersenmist.
De standaard laboratoriumtests waren natuurlijk normaal. De NASA-leuntest toonde echter aan dat ze neuraal gemedieerde hypotensie had (verlaagde bloeddruk bij staan). Ondanks langdurig gebruik van antivirale middelen (valacyclovir, valganciclovir) had ze soms matig hoge titers EBV-antilichamen. Toch suggereerden noch haar antilichamen noch een PCR-test dat ze een actieve infectie had.
Maar dan waren er nog de mitochondria…
De elektronenketencomplexen waar ATP uiteindelijk wordt geproduceerd, zijn voornamelijk gecodeerd door mitochondriaal chromosoom-DNA (ChrMT DNA, of mtDNA) dat via de moeder wordt doorgegeven. Het ChrMT-chromosoom is ook de plaats waar de eerste helft van het mitochondriale energieproductieproces – de Krebscyclus – met oxidatieve fosforylering (OXPHOS) plaatsvindt. Omdat de productie van ATP veel oxidatieve stress veroorzaakt (d.w.z. veel vrije radicalen) – stel je voor dat je naast een hoogoven zit – is dit deel van ons DNA zeer gevoelig voor oxidatieve schade en heeft het een hoog percentage mutaties.
Een diepe duik in haar mitochondriaal DNA en haar mitochondriën onthulde echter dat ze verschillende mitochondriale DNA-mutaties had (ATP6 (ChrMT: 8981A > G Q152R) en Cox1 (ChrMT: 6268C > T A122V)), waaronder één op een plaats (ATP6) waarvan bekend is dat deze mitochondriale problemen veroorzaakt.
Die ChrMT Cox1 mutatie was niet zomaar een mutatie. Ten eerste was ze nieuw in de literatuur. Ten tweede trad de mutatie op in een gen (Cox1) dat een belangrijke rol speelt in de latere stadia van de elektronentransportketen. De auteurs geloofden dat een mutatie die invloed had op deze stadia bijzonder schadelijk zou zijn en “progressieve effecten op de ATP-productie en mitochondriale functies” zou hebben.
Een van die effecten was een groot aantal disfunctionele extracellulaire mitochondriën. Deze mitochondria bleken blaasjesachtige structuren “uit te stulpen” of “uit te scheiden”, die leken op de structuren die gramnegatieve bacteriën produceren in stressvolle omstandigheden (!).
De auteurs stelden dat de extracellulaire, abnormale mitochondriën die gevonden werden bij haar en andere ME/cvs- en postinfectieuze patiënten waarschijnlijk het resultaat waren van een ontmoeting tussen een partij slecht functionerende mitochondriën en een virus.

De auteurs stelden dat personen met ME/cvs waarschijnlijk “disfunctionele mitochondriën” hadden die hen de voorbeschiktheid gaven om ME/cvs te ontwikkelen na virale infecties. Deze disfunctionele mitochondriën konden ofwel geërfd zijn, of gewijzigd door epigenetische veranderingen, en/of door een infectie.
Wat deze patiënte betreft, geloven ze dat haar mitochondriale mutaties waarschijnlijk een weerspiegeling waren van “geaccumuleerde mitochondriale stress” die tenminste gedeeltelijk veroorzaakt werd door haar blootstelling aan het epstein-barrvirus op 52-jarige leeftijd.
Om terug te komen op het erfelijkheidsonderzoek, raadden ze haar familie echter aan om een ChrMT DNA-sequentiebepaling te laten doen om “de mogelijke rol van virussen, mitochondriale DNA-mutaties en mitochondriale problemen in de invaliderende vermoeidheid bij postinfectieuze ziekten te helpen achterhalen”.
Hoewel we normaal gesproken de mitochondriën niet associëren met virussen, spelen de mitochondriën, zoals Dr. Naviaux heeft uitgelegd en zoals we in een recente blog hebben gezien, een centrale rol in onze afweer tegen virussen. Juist daarom zijn ze het doelwit van virussen die grote hoeveelheden “virologs” produceren in een poging om de mitochondriën te beschadigen en de immuunreactie uit te schakelen.
Verband tussen brein en mitochondriën
Maar laten we infectie even vergeten. Kunnen stressvolle omstandigheden op zichzelf leiden tot afbraak van de mitochondriën? Een recente dierstudie lijkt erop te wijzen dat dit mogelijk is.
Verschillende onderzoekers hebben gesteld dat een groot deel van de vermoeidheid bij ME/cvs komt door “centrale vermoeidheid”; d.w.z. vermoeidheid die wordt veroorzaakt door de hersenen. Behan en Chaudhuri’s werk uit 2004, “Fatigue in neurological disorders”, waarin ME/cvs herhaaldelijk werd genoemd, was een van de eersten die dit verband legde. Hun nadruk op de paden die de basale ganglia, thalamus, limbisch systeem en hogere corticale centra met elkaar verbinden, klinkt vandaag de dag nog steeds waar.
De gedachte dat centrale vermoeidheid een grote rol speelt bij ME/cvs, is in verschillende opzichten heel logisch. Ten eerste weten we dat de symptomen van “ziektegedrag” die we ervaren als we verkouden zijn, geproduceerd worden door de hersenen. Gezien zijn typische postinfectieuze aanvang, zou ME/cvs gewoon een zaak kunnen zijn van chronisch, onophoudelijk “ziektegedrag”.
Natuurlijk is de grote vraag hoe we de bevindingen van spierschade, bloedvat- en mitochondriale problemen die in de periferie van ME/cvs zijn opgedoken, kunnen verklaren. Hebben de hersenen zo’n grote reikwijdte?
Een fascinerend onderzoek van Daniel Clauw suggereerde van wel. In een ander onderzoek bij dieren ontdekte Clauw dat het verhogen van de activiteit van de insula – een orgaan van de hersenen dat betrokken is bij de regulering van het autonome zenuwstelsel en de sensorische verwerking – resulteerde in de ontwikkeling van dunnevezelneuropathie en een verhoogde pijngevoeligheid in de ledematen (!).
Een recent proefdiermodel, “Menselijke kenmerken nagebootst: Een veelbelovend diermodel van centrale vermoeidheid” wilde begrijpen hoe ver ‘centrale vermoeidheid’ zou kunnen gaan. Het creëerde eerst een toestand van centrale, of door de hersenen veroorzaakte, vermoeidheid via slaaptekort en om de dag vasten. Merk op dat er geen verhoogde fysieke inspanning werd geïntroduceerd – wat er ook gebeurde in de periferie, was niet het resultaat van inspanning.
Hoewel de muizen zichzelf niet inspanden, kregen hun spieren het zwaar te verduren. Ze vertoonden een verminderde grijpkracht en uithoudingsvermogen, een verhoogd lactaatniveau en energieverbruik en spieratrofie, waaronder een vermindering van de langzame spiervezels.
En dan waren er nog de mitochondriën. De mitochondriën zowel in de hersenen als in de spieren kregen het nog zwaarder te verduren. De auteurs merkten op dat mitochondriale problemen zijn gevonden bij een andere vermoeiende ziekte – ME/cvs- en rapporteerden dat ze verlaagde ATP-niveaus, verhoogde niveaus van oxidatieve stress, onregelmatig gevormde cellen, verhoogde heterochromatine in de kern, verlaagde niveaus van mitochondriën in het cytoplasma, gebroken of verdwenen binnenste cristae en gescheurde buitenste membranen hadden vastgesteld.
Uiteindelijk stelden de auteurs dat ze geloofden dat de vermoeidheid, het verminderde uithoudingsvermogen en de cognitieve problemen die gevonden werden bij de muizen met centrale vermoeidheid, verband hielden met mitochondriale schade, problemen met het energiemetabolisme en oxidatieve stress.
We waren terug bij af voor wat betreft de mitochondriën – en een brein dat blijkbaar een grote reikwijdte heeft.
Microstructurele mitochondriale afwijkingen
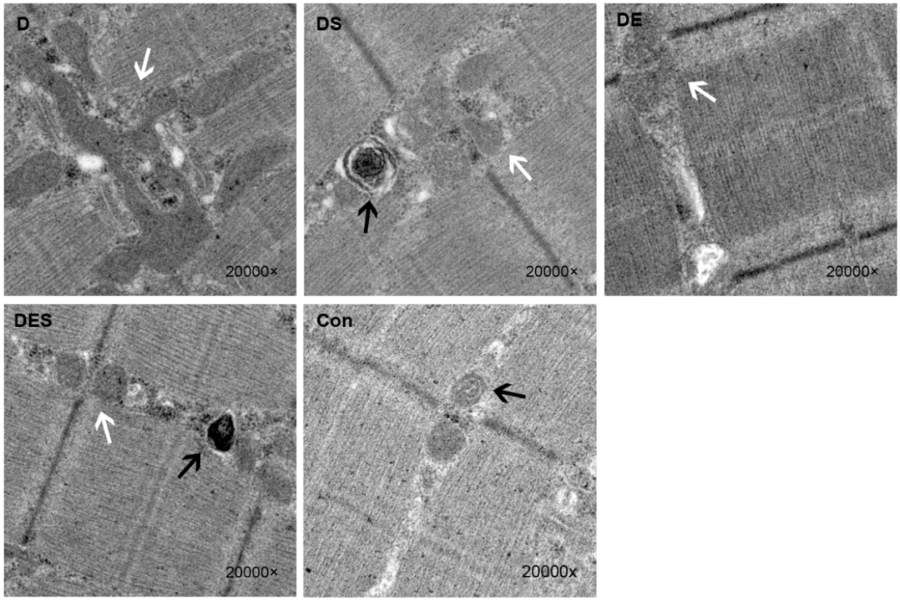
Een klein maar misschien veelzeggend onderzoek van Fereshtah Jahanbani aan Stanford (“Phenotypic characteristics of peripheral immune cells of Myalgic encephalomyelitis/chronic fatigue syndrome via transmission electron microscopy: A pilot study”, [Phenotypische kenmerken van perifere immuuncellen bij myalgische encefalomyelitis/chronischevermoeidheidssyndroom via transmissie-elektronenmicroscopie: een pilootstudie] gebruikte transmissie-elektronenmicroscopie (TEM) om diep te graven in de microstructuren (inclusief de mitochondriën) van zowel ongestimuleerde als gestimuleerde immuuncellen.
Er namen slechts vier mensen deel aan het onderzoek – een paar identieke tweelingen, waarvan er één matige ME/cvs had, een persoon met ernstige ME/cvs en een andere gezonde controlepersoon – maar het onderzoek leverde een aantal intrigerende resultaten op die hopelijk een vervolg zullen krijgen.
Immuunactivering is geen eenvoudig proces. Er is veel energie voor nodig en het is dus een mooie manier om het energiemetabolisme van een cel te testen. De rustig ogende monocyten veranderen bijvoorbeeld in harige monsters die macrofagen worden genoemd, en B- en T-cellen krikken hun energiestofwisseling op als zij zich voorbereiden om zichzelf in grote aantallen te klonen.
Onderzoekers hebben geopperd dat al die activiteit te veel is voor de nietige mitochondriën die gevonden worden bij personen met ME/cvs, waardoor de immuuncellen uitgeput raken (T-cellen) of er niet in slagen volgroeid te raken (B-cellen).
De auteurs van deze kleine studie zouden het hiermee eens kunnen zijn. Eenmaal gestimuleerd, begon het aantal dode en afstervende T-cellen bij de ME/cvs-patiënten zich op te stapelen, en de niveaus van gezwollen mitochondriën – een aanwijzing voor mitochondriale disfunctie – namen aanzienlijk toe. De auteurs rapporteerden dat de twee ME/cvs-patiënten “opmerkelijk hogere aantallen opgezwollen mitochondriën vertoonden”.
De oerzonde – beschadigde mitochondriën?
En opnieuw waren we terug bij de mitochondriën. Of het nu gaat om de hersenen, de spieren of de immuuncellen, deze onderzoeken – allemaal klein, dat moet gezegd worden – brachten ons terug naar wat heel goed de oerzonde van deze ziekten zou kunnen zijn: disfunctionele mitochondriën.
© Health Rising. Vertaling Els, redactie admin, ME-gids.








