
De kernpunten
- Avindra Nath stelt dat uitputting van B-cellen ME/cvs aanstuurt, maar in “Hypocortisolemic ASIA: a vaccine- and chronic infection-induced syndrome behind the origin of long COVID and myalgic encephalomyelitis” [ASIA met hypocortisolemie: een door vaccinatie en chronische infectie veroorzaakt syndroom aan de basis van langdurige COVID en myalgische encefalomyelitis], stellen Spaanse onderzoekers een andere mogelijke schuldige voor – uitgeputte T-cellen. Beide onderzoekers starten met een infectie, identificeren een zwakte van het immuunsysteem die leidt tot uitgeputte immuuncellen – en eindigen met het chronischevermoeidheidssyndroom (ME/cvs).
- Terwijl Nath uitkwam bij de temporale-pariëtale junctie (TPJ) in de hersenen, kwamen deze onderzoekers uit bij de hypofyse in de hersenen: twee immuunhypothesen – twee eindpunten in de hersenen…Interessant!
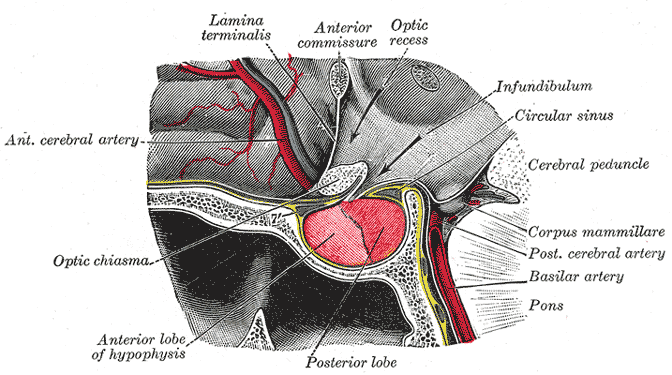
- De hypofyse maakt deel uit van de HPA-as – een van de twee belangrijkste stressreactiesystemen in het lichaam. Ze produceert adrenocorticotroop hormoon (ACTH) dat de bijnieren stimuleert om cortisol te produceren. Bij hypopituitarisme – het hypofyseprobleem dat volgens deze onderzoekers aanwezig is bij ME/cvs, produceert de hypofyse niet genoeg ACTH – wat leidt tot lage cortisolniveaus en waarschijnlijk vermoeidheid, ontstekingen, enz.
- De publicatie begint met de vaststelling dat herpes en andere virussen de activiteit van de HPA-as kunnen remmen, dat de plaats van de hypofyse ze bijzonder kwetsbaar maakt voor infecties en dat afhankelijk van de richting waarin de HPA-as omslaat, ofwel immunosuppressie (hoge cortisol), ofwel ontsteking of auto-immuunziekten (lage cortisol) het gevolg kunnen zijn.
- Blijkbaar kan EBV zich bij sommige personen richten op specifieke cellen in de hypofyse die de ACTH-afscheiding reguleren. Een rechtstreekse EBV-infectie van deze hypofysecellen zou de ACTH-productie kunnen verlagen en zo lage cortisolniveaus kunnen veroorzaken.
- Eén ME/cvs-studie vond antilichamen tegen de hypofyse/hypothalamus bij 35 à 55% van de patiënten. Deze antilichamen zouden een aandoening kunnen veroorzaken die auto-immune hypofysitis wordt genoemd, of ontsteking van de hypofyse.
- De auteur stelt dat een genetische zwakte in de T-helpercellen van sommige ME/cvs-patiënten hun immuunsysteem belet om het epstein-barrvirus snel te herkennen en te bestrijden. Als EBV reactiveert, springen de cytotoxische T-cellen (CD8) bij, maar zonder de T-helpercellen die hen naar de indringers kunnen leiden, schieten ze in het wilde weg, worden hyperactief en uiteindelijk uitgeput. Ondertussen beginnen B-cellen antilichamen te produceren die zijn ontworpen om de indringer of het antigeen (ziekteverwekker, gif) aan te pakken. Uiteindelijk raken ze de weg kwijt en vallen ze de hypofyse aan, wat auto-immunu hypofysitis (ontsteking van de hypofyse) veroorzaakt.
- In een laatste poging om de ziekteverwekkers onder controle te krijgen, komt het aangeboren immuunsysteem in actie – met ontstekingen en nog meer ravage tot gevolg – maar het slaagt er nooit in om de ziekteverwekker te verslaan.
- Het gevolg is een wereld vol problemen. De auteurs stellen dat dit scenario de weg vrijmaakt voor een grote verscheidenheid aan aandoeningen (verminderde vitamine D, insulineresistentie, verminderde zink-/koperniveaus, mestcelactivering, inspanningsintolerantie, laag testosterongehalte, orthostatische intolerantie, lekkende darmen, mitochondriale problemen, microglia-activering, neurotoxiciteit, concentratieproblemen, malaise en de afbraak van de spieren om aminozuren beschikbaar te maken voor de energieproductie).
- Behandelingsgedeelte – In tegenstelling tot Avindra Nath, die voorstelt om checkpointremmers (ICI’s) te gebruiken om het immuunsysteem weer op gang te krijgen, denken deze auteurs dat ICI’s het probleem alleen maar erger zullen maken. Door de uitgeputte T-cellen weer in actie te zetten, zal de hypofyseontsteking (hypofysitis) en/of de auto-immuunziekte die deze heeft veroorzaakt, verergeren. Als er geen infectie aanwezig is, denken ze dat de behandeling wel kan werken.
- Afhankelijk van de situatie waarin een patiënt zich bevindt, raden de auteurs verschillende oplossingen aan.
- In alle gevallen – Gebruik supplementen om oxidatieve stress te verminderen en de stoffen aan te vullen die zijn uitgeput door ontstekingen of malabsorptie en om de uitgeputte T-cellen nieuw leven in te blazen. Dit zijn onder andere vitamine C, n-acetylcysteïne (NAC), alfaliponzuur (ALA), S-adenosylmethionine (SAM-e), selenium en vitaminen uit het B-complex.
- Bij inflammatoire en immunosuppressieve toestanden – overweeg glutamine en nicotinamide mononucleotide (NMN) om de cytotoxische T-celwerking te herstellen, astragalus om te helpen bij de T-helpercelwerking en EBV-reactivering, eiwitsuppletie om de eiwitsynthese op peil te houden, vitamine D-suppletie om de hyperactivering van T-cellen te verminderen en de insulinegevoeligheid te verbeteren, en melatonine om neuronen te beschermen, oxidatieve stress te verminderen en de slaap te verbeteren. Gebruik antibiotica en antihistaminica om ontstekingen te verminderen bij mensen met bacteriële overgroei in de dunne darm (SIBO).
- Geen hypofysebeschadiging, normale ACTH-niveaus en hyporesponsieve HPA-as (laag cortisol) – Dit kan passen bij sommige mensen met ME/cvs. Probeer supplementen die ontstekingen en oxidatieve stress verminderen en de cortisolproductie stimuleren, zoals ginseng. Voeg andere supplementen toe (zie hierboven).
- Een verband met de wervelkolom – Hoewel het niet wordt genoemd in deze publicatie, komt de verbinding tussen wervelkolom en hypofyse voort uit een aandoening die het legesellasyndroom (ESS) wordt genoemd – die optreedt wanneer de benige structuur die de hypofyse op zijn plaats houdt, afgeplat raakt. Dit is meestal het gevolg van een hoge druk van het hersenvocht (intracraniële hypertensie) – wat veel lijkt voor te komen bij ME/cvs. In een podcast van Unraveled meldde Dr. Ruhoy dat ze ESS of gedeeltelijk lege sella ziet bij 80 à 90% van haar patiënten met craniocervicale instabiliteit.
- Conclusie:
- Zowel de hypothese van Avindra Nath als die van deze onderzoekers vertrekken van hetzelfde punt – een infectie – stellen dat een immuundefect (in B- of T-cellen) resulteert in een onvermogen om de infectie aan te pakken, in immuunuitputting en auto-immuniteit/ontsteking, en dat dit uiteindelijk zorgt voor een probleem in de hersenen (TPJ, hypofyse).
- De een stelt een aanpak van het immuunsysteem voor (checkpointremmers) wat volgens de ander de dingen veel erger (!) zal maken. In plaats van checkpointremmers concentreren de Spaanse onderzoekers zich meer op het tijdelijk gebruik van corticosteroïden, plus antivirale middelen en een reeks supplementen om de werking van T-cellen en de HPA-as te herstellen, oxidatieve stress te verminderen, enz.
- Met B- en T-cellen, en zelfs neutrofielen en monocyten bij ME/cvs die allemaal tekenen vertonen van immuunuitputting en/of problemen met het leveren van energie, vraagt men zich af of problemen met energieproductie niet de verbindende factor is.
Het wordt uitputtend om deze onderzoeken naar immuunuitputting bij te houden. Avindra Nath beweert dat uitputting van de B-cellen ME/cvs veroorzaakt, maar in “Hypocortisolemic ASIA: a vaccine- and chronic infection-induced syndrome behind the origin of long COVID and myalgic encephalomyelitis” [ASIA met hypocortisolemie: een door vaccinatie en chronische infectie veroorzaakt syndroom aan de basis van langdurige COVID en myalgische encefalomyelitis], stellen Spaanse onderzoekers een andere mogelijke verdachte voor – uitgeputte T-cellen. Beide onderzoekers starten bij een infectie, identificeren een immuunzwakte die leidt tot uitgeputte immuuncellen – en eindigen met het chronischevermoeidheidssyndroom (ME/cvs).
Terwijl Nath uitkomt bij de temporale-pariëtale junctie (TPJ) in de hersenen, komen deze onderzoekers uit bij de hypofyse in de hersenen: twee immuunhypothesen – twee eindpunten in de hersenen…Interessant!
De hypofyse
De hypofyse heeft wat in de marge van het ME/cvs-onderzoek rondgehangen, maar krijgt nu wat meer aandacht – in ieder geval van artsen – en ze bestuderen de problemen met de wervelkolom meer. Deze kleine klier, die zich net onder de hypothalamus bevindt, heeft een buitenmaats effect op het lichaam.
De hypofyse maakt deel uit van de HPA-as – een van de twee belangrijkste stressreactiesystemen in het lichaam. Ze produceert adrenocorticotroop hormoon (ACTH) dat de bijnieren stimuleert om cortisol te produceren. Bij hypopituitarisme – het hypofyseprobleem dat volgens deze onderzoekers aanwezig is bij ME/cvs, produceert de hypofyse niet genoeg ACTH – wat leidt tot lage cortisolniveaus en waarschijnlijk vermoeidheid, ontstekingen, enz.
Lage cortisolniveaus waren een van de eerste afwijkingen die gevonden werden bij ME/cvs. Dr. Kaufman stelde dat vrijwel iedereen met ME/cvs (ca 90%) een probleem heeft met de hypothalamus-hypofyse-as – wat het gevolg zou kunnen zijn van intracraniële hypertensie die de hypofyse ondermijnt. Lage cortisolspiegels zijn ook verschillende keren weer opgedoken bij long covid.
Het is echter nooit duidelijk geworden hoe belangrijk de verschillende afwijkingen van de HPA-as bij ME/cvs zijn. Het onderzoek naar de HPA-as bij ME/cvs bloeide in het begin, maar liep in de loop van de tijd langzaam dood omdat er weinig harde conclusies getrokken werden. Er blijven metingen van de HPA-as opduiken, maar je krijgt het gevoel dat onderzoekers nooit echt in staat zijn geweest om de vinger te leggen op wat er aan de hand is met de HPA-as bij ME/cvs.
Zelfs de lage cortisolresultaten zijn de laatste tijd onder verdenking komen te staan bij zowel ME/cvs als bij langdurige covid, vanwege de bezorgdheid dat onderzoekers geen rekening hebben gehouden met veranderde circadiaanse ritmes die de cortisolmetingen in de ochtend in de war gestuurd kunnen hebben. (Janet Mullington onderzoekt deze kwestie bij ME/cvs in een door de Open Medicine Foundation gefinancierde studie (blog komt eraan).
Epstein-barrvirus
De nieuwe paper begint met de erkenning dat herpes en andere virussen de activiteit van de HPA-as kunnen remmen, dat de locatie van de hypofyse ze bijzonder kwetsbaar maakt voor infecties en dat afhankelijk van welke kant de HPA-as uitgaat, ofwel immunosuppressie (hoog cortisol), ofwel ontsteking of auto-immuunziekten (laag cortisol) het gevolg kunnen zijn.
Net als bij de HPA-as is het nog onduidelijk of EBV-reactivering een belangrijke rol speelt bij ME/cvs. Er zijn verhoogde anti-EBV-dUTPase-antilichamen, gestoorde B- en T-celreacties op EBV, verhoogde percentages van actieve EBV-infectie en verhoogde IgM-antilichamen gevonden, maar wisselende resultaten op het gebied van antilichamen, onzekerheden over actieve infectie en normale virale EBV-waarden maken het nog steeds onduidelijk welk effect EBV heeft.
De auteurs stellen echter dat EBV de cruciale schakel is bij ME/cvs. In hun artikel uit 2021, “Epstein-Barr Virus and the Origin of Myalgic Encephalomyelitis or Chronic Fatigue Syndrome” [Het epstein-barrvirus en het ontstaan van myalgische encefalomyelitis of het chronischevermoeidheidssyndroom], stelden dezelfde auteurs dat de Th2-immuunverschuiving die soms bij ME/cvs wordt gezien, ME/cvs-patiënten kwetsbaar heeft gemaakt voor EBV-reactivering.
Het blijkt dat EBV bij sommige individuen specifieke cellen in de hypofyse kan aantasten die de ACTH-secretie regelen, waardoor de afscheiding afneemt en er een laag cortisolniveau ontstaat.
ASIA
In een onderzoek van Stanford uit 2021 werden inderdaad verhoogde percentages APA-antistoffen (33%) tegen de hypofyse, en AHA-antistoffen (56%) tegen de hypothalamus, gevonden die geassocieerd werden met een verminderde reactie op de HPA-as. Deze antilichamen zouden een aandoening kunnen veroorzaken die auto-immune hypofysitis wordt genoemd, of inflammatie van de hypofyse. De auteurs geloven dat sommige ME/cvs-patiënten een aandoening hebben die adjuvant-geïnduceerd auto-immuun/inflammatoir syndroom (ASIA) wordt genoemd en die de hypofyse beschadigt.
ASIA dook op in de wetenschappelijke literatuur in 2011 toen een Israëlische immunoloog, Yehuda Shoenfeld, suggereerde dat het optreedt wanneer genetisch gevoelige individuen reageren op een van de “hulpstoffen” of stoffen die worden toegevoegd aan vaccins of andere verbindingen om hun effectiviteit te vergroten. Deze hulpstoffen zijn bijvoorbeeld aluminiumzouten, emulsies, oliën, spike (S) proteïne, Toll-like receptoragonisten, mRNA-vaccinlipiden en polyethyleenglycol.
Na verloop van tijd stelde Shoenfield dat ASIA aanwezig is bij ziekten als “postvaccinatiesymptomen”, Golfoorlogsyndroom, sickbuildingsyndroom, syndroom van Sjögren en siliconose – die allemaal een aantal vertrouwde symptomen vertonen: laag cortisol, chronische vermoeidheid, niet verkwikkende slaap, slaapstoornissen, cognitieve problemen en geheugenverlies. De auteurs van dit artikel stellen voor om long covid, ME/cvs en het post-COVID-19-vaccinsyndroom aan die lijst toe te voegen.
Een van de meest voorkomende vormen van ASIA is auto-immune hypofysitis en een deficiëntie van het adrenocorticotroop hormoon (ACTH).
Op de voorgrond: genetische aanleg
De auteurs geloven dat, wanneer verschillende factoren (infecties, lichaamsvreemde stoffen, hulpstoffen in vaccins) op elkaar inwerken bij een persoon met een bepaalde genetische aanleg (voorouderlijke HLA-II allelen – HLA-DR15), er problemen ontstaan. Meer specifiek, een onvermogen om meer T-helpercellen (CD4) aan te maken laat niet alleen de ziekteverwekker zichzelf vermenigvuldigen, maar veroorzaakt ook compensatoire immuunreacties die hun eigen complicaties opleveren.
Als de T-helpercellen – die het immuunsysteem waarschuwen voor de aanwezigheid van indringers – de indringers niet kunnen herkennen, komen de latente herpesvirussen in de B-cellen uit hun schuilplaats en reactiveren ze. De cytotoxische T-cellen (CD8) springen in actie, maar zonder de T-helpercellen die hen naar de indringers leiden, schieten ze in het wilde weg, worden hyperactief en uiteindelijk uitgeput. Ondertussen beginnen de B-cellen antilichamen te produceren tegen de indringer of het antigeen (ziekteverwekker, gif). Uiteindelijk raken deze de weg kwijt en vallen ze de hypofyse aan, waardoor een aandoening ontstaat die auto-immuun hypofysitis (ontsteking van de hypofyse) wordt genoemd.

In een ultieme poging om de ziekteverwekkers onder controle te krijgen, schiet het aangeboren immuunsysteem in actie – waarbij het inflammatie en nog meer ravage aanricht – maar het slaagt er nooit in om de ziekteverwekker te vernietigen. (Het aangeboren immuunsysteem is niet ontworpen om het lichaam te ontdoen van infecties). (Een soortgelijk scenario van activering van het aangeboren immuunsysteem door een slecht presterend adaptief immuunsysteem werd voorgesteld door Avindra Nath – maar dan met disfunctionele B-cellen. Aangezien B- en T-cellen de adaptieve immuunreactie aansturen, kan men aannemen dat die tak van het immuunsysteem het niet zo goed doet bij ME/cvs).
Het gevolg is een wereld vol problemen. De aanhoudende chronische inflammatie verhoogt de behoefte van het immuunsysteem aan vitamine D en kan leiden tot insulineresistentie als de vitamine D-kwestie niet wordt aangepakt. Lage zink- en koperniveaus kunnen ook het gevolg zijn. Tegelijkertijd vinden de auteurs een manier om mestcelactivering, kortdurende hypoglycemie en inspanningsintolerantie eraan te koppelen.
De ontstane auto-immune hypofysitis onderdrukt de ACTH-afscheiding in de hypofyse, met als gevolg een laag cortisolgehalte en, door de afname van DHEA en DHEA-s, mogelijk ook een laag testosterongehalte. De lage cortisol geeft symptomen zoals intense vermoeidheid, duizeligheid, concentratieproblemen, moeite om je in te spannen en een algemeen gevoel van malaise.
De pro-inflammatoire cytokines die worden losgelaten door het aangeboren immuunsysteem in combinatie met de compensatoire CD8 T-celactivering, kunnen zelfs leiden tot spierafbraak en het vreemde patroon dat wordt aangetroffen bij ME/cvs waarbij aminozuren bij voorrang worden gebruikt om energie te leveren.
De auteurs slagen er zelfs in om darmdisfunctie, lekkendedarmsyndroom, SIBO, beschadiging van de bloed-hersenbarrière, verminderde tryptofaan, oxidatieve stress, mitochondriale problemen, calciumophopingen, anaeroob metabolisme, microgliale activering, neurotoxiciteit en, natuurlijk, neuro-inflammatie erbij te betrekken.
In navolging van de Dauer-hypothese van Dr. Naviaux geloven de auteurs dat de immuunuitputting die optreedt bij postinfectieuze ziekten geen falen van het immuunsysteem is, maar een compensatiemechanisme ontworpen om de verspreiding van intracellulaire ziekteverwekkers af te remmen door ze de tryptofaan te ontzeggen die ze nodig hebben om zich te vermenigvuldigen.
Het is een hele krachttoer! Tegen de tijd dat we bij voetnoot 231 zijn, komen we bij het onderdeel behandeling.
Behandeling
Afhankelijk van de situatie waarin een patiënt zich bevindt, raden de auteurs verschillende oplossingen aan.
Nee tegen checkpointremmers als er infectie aanwezig is – De auteurs denken dat het gebruik van checkpointremmers – precies de medicijnen die Avindra Nath voorstelde om te onderzoeken voor ME/cvs – om de uitgeputte T-cellen weer aan het werk te krijgen, de hypofyseontsteking (hypofysitis) en/of de auto-immuunziekte aan de basis ervan, zal verergeren. Als er geen infectie aanwezig is, denken ze dat de behandeling wel kan werken.
In alle gevallen – Gebruik supplementen om oxidatieve stress te verminderen en de stoffen aan te vullen die uitgeput zijn door ontstekingen of malabsorptie en om de uitgeputte T-cellen nieuw leven in te blazen. Dit zijn onder andere vitamine C, n-acetylcysteïne (NAC), alfaliponzuur (ALA), S-adenosylmethionine (SAM-e), selenium en vitaminen uit het B-complex.
Begin van de ziekte veroorzaakt door infectie – Gebruik corticosteroïden en antivirale middelen bij het begin van de ziekte voor een korte periode om de productie van antilichamen die de hypofyse aanvallen, te verminderen, om het virus uit te schakelen en de T-celuitputting te verminderen. Het uitschakelen van de ziekteverwekker is cruciaal, omdat men denkt dat het de ziekteverwekker is die de productie van antilichamen tegen de hypofyse aanstuurt.
Overweeg om DHEA toe te voegen om de ACTH-productie te ondersteunen. Voeg supplementen toe (zie hierboven).
Bij inflammatoire en immunosuppressieve toestanden – overweeg glutamine en nicotinamide mononucleotide (NMN) om de cytotoxische T-celwerking te herstellen, astragalus om te helpen bij de T-helpercelwerking en EBV-reactivering, eiwitsuppletie om de eiwitsynthese op peil te houden, vitamine D-suppletie om de hyperactivatie van T-cellen te verminderen en de insulinegevoeligheid te verbeteren, en melatonine om neuronen te beschermen, oxidatieve stress te verminderen en de slaap te verbeteren. Gebruik antibiotica en antihistaminica om ontstekingen te verminderen bij personen met bacteriële overgroei in de dunne darm (SIBO).
Begin van de ziekte niet veroorzaakt door infectie – gebruik een korte tijd corticosteroïden om de productie van antilichamen tegen de hypofyse te verminderen. Overweeg aanvulling met DHEA corticosteroïden om de ACTH-secretie te remmen. Voeg supplementen toe (zie hierboven).
Er is hypofysebeschadiging opgetreden – Als de hypofyse beschadigd is, kunnen corticosteroïden langdurig nodig zijn om de werking van de bijnieren in stand te houden. Overweeg suppletie met DHEA corticosteroïden om de ACTH-secretie te remmen. Voeg supplementen toe (zie hierboven).
Geen hypofysebeschadiging, normale ACTH-spiegels en hyporesponsieve HPA-as (laag cortisol) – probeer supplementen die ontstekingen en oxidatieve stress verminderen en de cortisolproductie stimuleren, zoals ginseng. Voeg andere supplementen toe (zie hierboven).
Aangezien studies een laag cortisolgehalte in het speeksel hebben gevonden bij ME/cvs, maar soms normale ACTH-niveaus bij sommige ME/cvs-patiënten, zal langdurige covid in deze categorie passen.
Het verband met de wervelkolom
Hoewel het niet vermeld wordt in deze publicatie, komt de wervelkolom-hypofyse-connectie voort van een aandoening genaamd legesellasyndroom (empty sella syndrome ESS) – die optreedt wanneer de benige structuur die de hypofyse op zijn plaats houdt, afgeplat raakt. Dit is meestal het gevolg van een hoge druk van het hersenvocht (intracraniële hypertensie) – wat veel lijkt voor te komen bij ME/cvs.
Hulens gelooft dat intracraniële hypertensie een belangrijke rol speelt bij sommige ME/cvs- en/of fibromyalgiepatiënten en dat het geassocieerd kan worden met een verminderde reactie op adrenocorticotroop hormoon (ACTH), cortisol, groeihormoon, luteïniserend hormoon en schildklierstimulerend hormoon en een verhoogde reactie op prolactine bij deze ziekten.
Lees ook: High Intracranial Fluid Pressure, ME/CFS, Fibromyalgia and Long COVID
In een podcast van Unraveled meldde Dr. Ruhoy dat ze bij 80 à 90% van haar patiënten met craniocervicale instabiliteit ESS of gedeeltelijk lege sella ziet. Ze heeft ook een verhoogde prolactine gevonden bij veel van haar patiënten, wat ook verband zou kunnen houden met de hypofyseproblemen via compressie van de hypothalamussteel.(?)
Lees ook: Idiopathische intracraniële hypertensie bij ME/cvs en complexe ziekten – Uit de Podcast Unraveled
Conclusie
Twee hypothesen die uitgaan van hetzelfde vertrekpunt – een infectie – stellen dat een immuundefect (in B- of T-cellen) leidt tot een onvermogen om de infectie aan te pakken, tot immuunuitputting en auto-immuniteit/inflammatie, en dat dit uiteindelijk resulteert in een probleem in de hersenen (TPJ, hypofyse).
De een stelt een immunologische aanpak voor (checkpointremmers) waarvan de ander denkt dat het de situatie veel erger zal maken (!). In plaats van checkpointremmers concentreren de Spaanse onderzoekers zich meer op het tijdelijk gebruik van corticosteroïden, plus antivirale middelen en een reeks supplementen om het functioneren van T-cellen en de HPA-as te herstellen, oxidatieve stress te verminderen, enz.
Met B- en T-cellen, en zelfs neutrofielen en monocyten, die bij ME/cvs allemaal tekenen vertonen van immuunuitputting en/of moeilijkheden met het produceren van energie, vraagt men zich af of problemen met energieproductie niet de link is die ze met elkaar verbindt.
Lees ook: Cellular Energy Production Takes Big Hit in Chronic Fatigue Syndrome (ME/CFS) Study
© Health Rising, 14 november 2024. Vertaling Els, redactie admin, ME-gids.






