Epidemiologische studies tonen geen duidelijke relatie tussen hypermobiliteit en wijdverspreide pijn. Dit zet vraagtekens bij de geldigheid van diagnoses zoals hypermobiliteitsspectrumsstoornis (HSD) en hypermobiel Ehlers-Danlossyndroom (hEDS). Op basis van de prevalentie, symptoompresentatie, vrouwelijk overwicht en gebrek aan moleculaire basis lijkt hEDS meer op fibromyalgie en ME/cvs dan op andere EDS-types. De British Society of Paediatric and Adolescent Rheumatology uitte haar bezorgdheid over het feit dat het toeschrijven van symptomen aan HSD/hEDS zonder bewijs van bindweefselaandoeningen waarschijnlijk niet nuttig is en schade kan veroorzaken.

De vreemde eend in de bijt
Het Ehlers-Danlossyndroom (EDS) is een groep erfelijke bindweefselaandoeningen die wordt gekenmerkt door hypermobiliteit van de gewrichten, hyperextensibiliteit van de huid en fragiliteit van het weefsel. De meest recente diagnostische criteria, gepubliceerd in 2017, identificeren 13 EDS-subtypes. Twaalf daarvan hebben een bekende genetische mutatie waarbij de collageensynthese of andere extracellulaire matrixeiwitten betrokken zijn. Dit zijn (zeer) zeldzame aandoeningen met een geïdentificeerde moleculaire basis en prominente klinische symptomen. Klassieke EDS, bijvoorbeeld, staat bekend om hyperextensibele en fragiele huid en heeft een geschatte prevalentie van 1 op 20.000 mensen (0,005%). Vasculaire EDS verhoogt het risico op slagaderlijke rupturen en komt voor bij slechts 1 op 90.000 mensen (0,001%). Andere EDS-types zijn nog zeldzamer met kenmerken zoals een abnormale kromming van de wervelkolom, spontane klaplongen of scheuring van het hoornvlies in het oog.
De vreemde eend in de bijt is hypermobiel EDS (hEDS). Van de 13 EDS-types is dit de enige die geen bekende moleculaire basis of genetische mutatie heeft. Met een geschatte prevalentie van 1 op 5000 (0,020%) komt het veel vaker voor dan andere EDS-types. Van de overgrote meerderheid (ongeveer 80-90%) van de EDS-patiënten wordt aangenomen dat ze hEDS heeft.
Maar ondanks dat hEDS de EDS-populatie domineert, wordt het ook beschouwd als de meest controversiële diagnose. Het wordt gekenmerkt door aspecifieke kenmerken zoals gewrichtshypermobiliteit en wijdverspreide pijn, die veel voorkomen in de algemene bevolking. In plaats van door specifieke klinische symptomen onderscheidt hEDS zich door een breed scala aan invaliderende maar slecht verklaarbare symptomen, van spijsverteringsproblemen, vermoeidheid en urine-incontinentie tot frequente gewrichtsluxatie en duizeligheid na het opstaan. Omdat er geen bindweefseldefect is vastgesteld*, hebben onderzoekers hun bezorgdheid geuit dat slecht verklaarde symptomen ten onrechte worden toegeschreven aan hEDS. In 2017 schreven vertegenwoordigers van The Royal College of Paediatrics en The British Society of Paediatric and Adolescent Rheumatology bijvoorbeeld:
“We zijn zeer bezorgd dat, bij gebrek aan een definieerbaar weefselmechanisme voor dergelijke symptomen, het toeschrijven van systemische symptomen aan JHS/hEDS zeer waarschijnlijk niet behulpzaam is voor de patiënt en de familie en zelfs schade kan toebrengen. […] Er is ongetwijfeld veel onenigheid over de diagnose van hEDS (we verwelkomen zelfs verdere discussie), maar onweerlegbaar is het feit dat er op dit moment geen bewijs bestaat dat dit een collageenstoornis is (bij kinderen of volwassenen) of dat het verband houdt met multisysteemziekten.”
JHS verwijst naar het gewrichtshypermobiliteitssyndroom, een diagnose die erg lijkt op hEDS. Een groep onderzoekers onder leiding van Rodney Grahame en Alan Hakim in het Verenigd Koninkrijk heeft ervoor gepleit om symptomatische gewrichtshypermobiliteit te zien als een ‘forme fruste’, een verzwakte manifestatie van bindweefselziekte. De prevalentie van JHS is veel hoger dan die van hEDS, sommige reviews beweren dat 3% van de bevolking erdoor wordt getroffen. In de diagnostische criteria van 2017 werd de diagnose JHS verworpen omdat deze sterk overlapt met hEDS. hEDS heeft nu voorrang en patiënten met symptomatische gewrichtshypermobiliteit die niet voldoen aan de hEDS-criteria, krijgen het label hypermobiliteitsspectrumstoornis (HSD).
Beide diagnoses gaan ervan uit dat gegeneraliseerde hypermobiliteit van gewrichten duidt op een bindweefselaandoening die meerdere symptomen en lichamelijke afwijkingen veroorzaakt. Deze theorie is problematisch omdat hypermobiliteit veel voorkomt in de algemene bevolking en vaak asymptomatisch is. Het bewijs dat het verband houdt met pijn of andere symptomen is niet overtuigend.
Beighton score
Voordat we verder gaan met het bespreken van het epidemiologisch bewijs, moeten we eerst iets zeggen over wat gegeneraliseerde gewrichtshypermobiliteit is en hoe het wordt gemeten. De Beighton-score (0-9) is verreweg het meest gebruikte instrument. In het kort beoordeelt het:
- Of je je pink verder dan 90 graden naar achteren kunt buigen,
- Of je duim je onderarm raakt wanneer je je pols buigt,
- Of je ellebogen verder naar achteren buigen dan normaal recht is (-10 graden of meer),
- Of je knieën verder naar achteren buigen dan normaal recht is (-10 graden of meer),
- Of je de vloer kunt bereiken met je handpalmen terwijl je je benen recht houdt.
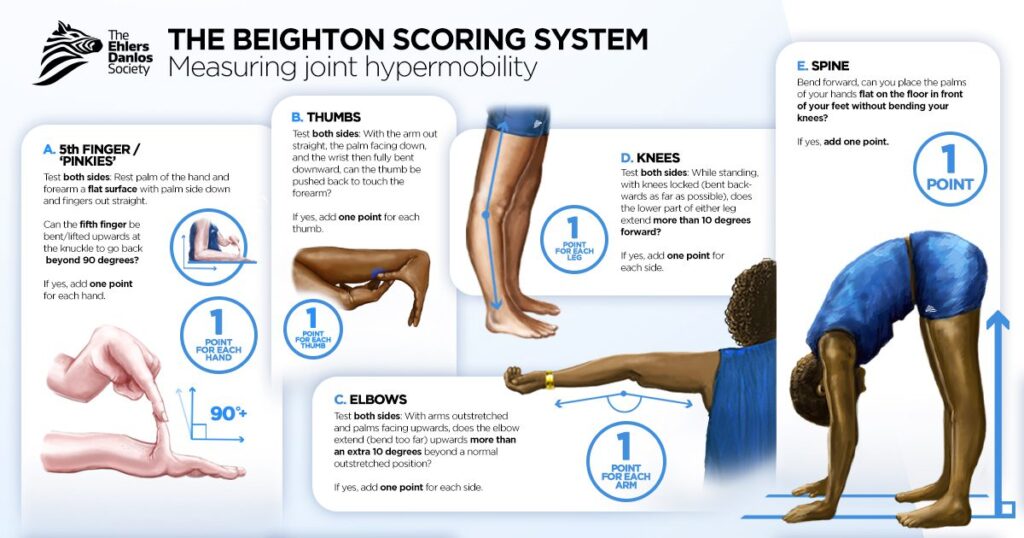
Voor de eerste vier krijg je een apart punt voor elke lichaamszijde waarop de stelling van toepassing is, wat resulteert in een maximale Beighton-score van 9 punten. Video’s over hoe onderzoekers het Beighton-scoresysteem toepassen, kun je hier en hier bekijken.
Afhankelijk van uw leeftijd en de diagnostische criteria worden Beighton-scores van 4, 5 of 6 gebruikt om aan te geven dat er sprake is van gegeneraliseerde gewrichtshypermobiliteit. Merk op dat mensen die aan deze drempelwaarde voldoen, hypermobiliteit in verschillende gewrichten kunnen hebben: het geeft geen homogene populatie weer, omdat er meerdere manieren zijn om de drempelwaarde te bereiken. Een ander probleem met de Beighton-score is dat hij ‘topzwaar’ is: het beoordeelt vooral de bovenste ledematen en houdt geen rekening met het onderlichaam en belangrijke gewrichten zoals de heupen. En misschien wel het belangrijkste, het beoordeelt niet de ernst of intensiteit van de gewrichtshypermobiliteit: het geeft alleen een punt als een van de beoordelingen positief is.
De Beighton-score werd 50 jaar geleden ontwikkeld als een snel screeningsinstrument voor hypermobiliteit in Zuid-Afrika. Tegenwoordig lijkt de belangrijkste rechtvaardiging voor het gebruik ervan te zijn dat het al veel wordt gebruikt. Het blijft echter het meest gebruikte instrument in onderzoek en de methode waarop alle diagnostische criteria berusten. Daarom zullen we tijdelijk de tekortkomingen ervan over het hoofd moeten zien om over te gaan naar het hoofdonderwerp van deze blog: is er een verband tussen hypermobiliteit en hEDS/JHS-symptomen zoals pijn aan het bewegingsapparaat?
Geen verband tussen hypermobiliteit en pijn
Om die vraag te beantwoorden, hebben we epidemiologische studies nodig die een representatieve steekproef van de algemene bevolking onderzoeken. De meeste van deze studies zijn uitgevoerd bij kinderen of jonge adolescenten en vonden dat gegeneraliseerde gewrichtshypermobiliteit vaker voorkomt bij jonge, vrouwelijke en niet-westerse populaties. Studies in Afrikaanse en Aziatische landen vonden hogere prevalentiecijfers van gewrichtshypermobiliteit dan Europese studies en sommige wijzen op een verband met factoren zoals ondervoeding. Resultaten worden daarom vaak gegroepeerd per etniciteit om heterogeniteit te verminderen.
Een systematische review uit 2012 vond geen verband tussen hypermobiliteit en pijnklachten aan het bewegingsapparaat in Amerikaanse en Europese studies (Odds ratio: 1,00 [0,79 -1,26]). We hebben ook een overzicht gemaakt van epidemiologische studies bij kinderen en adolescenten in westerse landen (tabel 1) en kwamen tot dezelfde conclusie: de meeste studies laten geen verband zien. Als je een populatie in tweeën deelt op basis van de vraag of ze gegeneraliseerde gewrichtshypermobiliteit hebben, is de frequentie van artralgie (gewrichtspijn) en musculoskeletale pijn in beide groepen ongeveer hetzelfde. Een Italiaanse studie rapporteerde bijvoorbeeld dat “er geen verband werd gevonden tussen hypermobiliteit en pijn aan het bewegingsapparaat. Hypermobiele kinderen ervoeren geen functionele beperkingen in dagelijkse activiteiten en ze waren iets actiever dan niet-hypermobiele kinderen.”
| Studie | Resultaat | Populatie | Bevindingen |
| Fairbank 1984 | Rugpijn | N = 446 13-17 jarigen VK | 26% had rugpijn. Femorale en tibiale rotatie waren significant minder bij de leerlingen met rugpijn. Er werd geen verschil vastgesteld in de gewrichtsmobiliteitsmetingen van de bovenste ledematen van de leerlingen met en zonder rugpijn. |
| Gedalia 1985 | Juveniele episodische artritis/artralgie (JEA) | N =260 5-17 jarigen VS | Er werden verschillende cohorten met verschillende selectiecriteria gebruikt. Hypermobiliteit kwam vaker voor bij JEA (66%) dan bij controles (12%) en reumatoïde artritis (3%). |
| Arroyo 1988 | Artralgie | N = 192 5-19 jarigen VS | 34% was hypermobiel en 50% van de hypermobiele groep had een voorgeschiedenis van artralgie, vergeleken met 20% van de controles. 10% in elke groep had artritis. |
| Gedalia 1991 | Terugkerende artralgie | N = 429 6-11 jarigen Israël | 12% had hypermobiliteit. Recidiverende artralgie kwam vaker voor (40%) in de hypermobiele groep dan in de niet-hypermobiele groep (17%). |
| Mikkelsson 1996 | Minstens één keer per week pijn | N = 1637 kinderen Finland | 7,8% had een Beighton-score ≥ 6. 29,9% met hypermobiliteit had pijn vergeleken met 32,3% in de controles. Hypermobiliteit in één gewricht was niet geassocieerd met pijn in dat lichaamsgebied. Invaliditeit correleerde niet met de totale Beighton-score. |
| Harreby 1999 | Lage rugpijn (LBP) | N = 1389 13-16 jarigen Denemarken | 14% hypermobiliteit, 19,4% had LBP. “Algemene hypermobiliteit op elk niveau […] was in geen enkele mate gecorreleerd met LBP.” |
| Qvindesland 1999 | PIjn | N = 267 12 jarigen IJsland | 27,7% had Beighton ≥ 4. 55% van de hypermobiele patiënten rapporteerde pijn versus 52% van de controles. |
| Ruperto 2004 | Functioneel vermogen (CHAQ) en welzijn (CHQ) inclusief lichamelijke pijn | N = 311 6-19 jarigen Italië | 34% had hypermobiliteit volgens Beighton ≥ 5. “De aanwezigheid van hypermobiliteit van gewrichten heeft geen invloed op het functionele vermogen en het fysieke en psychosociale welzijn van verder gezonde kinderen.” |
| Leone 2009 | Musculoskeletale pijn, invaliditeit en fysieke activiteit | N = 1230 7-15 jarigen Italië | 22,2% had Beighton ≥ 5. 22% van de kinderen met pijnklachten aan het bewegingsapparaat versus 23% van de controles had hypermobiliteit (OR 1,057, 95% CI 0,7 tot 1,4). “Hypermobiele kinderen ervoeren geen functionele beperkingen in dagelijkse activiteiten en ze waren iets actiever dan niet-hypermobiele kinderen” |
| Juul-Kristensen 2009 | Musculoskeletale klachten | N = 411 8 jarigen Denemarken | “29% van de kinderen had GJH4, 19% had GJH5, 10% had GJH6 en 9% had BJHS. Er was geen verschil in dagelijks niveau en duur van fysieke activiteit en in frequentie van musculoskeletale pijn en blessures tussen personen met en zonder GJH.” |
| Smits-Engelmans 2011 | Pijn in gewrichten, spieren of ligamenten | N = 551 6-12 jarigen Nederland | 35% had Beighton ≥5, 12,5% had gewrichtspijn die lager was bij personen met hoge hypermobiliteit 64% Beighton<5: 13,3% gewrichtspijn26,5% Beighton<7>5: 12,8% gewrichtspijn9,1% Beighton>7: 4,1% gewrichtspijn |
| Sperotto 2014 | Chronische musculoskeletale pijn | N = 289 8-13 jarigen Italië | 13,2% had Beighton≥4. 32% van de hypermobiele patiënten had MSP vergeleken met 29% bij de controles (p=0,054). |
| Aartun 2016 | Nek- en rugpijn | N = 963 11-15 jarigen Denemarken | 6,5% had een Beighton-score ≥ 5 en 4,25% ≥ 6. Nek- en rugpijn kwamen > 50% voor. Hypermobiliteit had geen significante associatie of voorspellende waarde voor pijn. |
| Morris 2016 | Aantal pijnlocaties | N = 1584 14 jarigen Australië | 48% had Beighton≥4 en 18,6% Beighton≥6. Bij jongens was er een verband met hypermobiliteit en meer dan 3 pijnlocaties, maar niet bij meisjes en alleen voor Beighton≥6 drempel. Er werd geen verband gevonden voor het aantal pijngebieden dat >3 maanden aanhield, zowel bij jongens als bij meisjes bij beide drempels. |
Verschillende studies volgden patiënten in de loop van de tijd en meldden dat hypermobiliteit een voorspeller was van toekomstige pijn, maar ze komen met belangrijke kanttekeningen. Uit een Deense studie bleek bijvoorbeeld dat de pijn significant slechter was in de hypermobiliteitsgroep, maar alleen wanneer gedefinieerd door een Beighton-score van 4 of hoger, en niet wanneer de drempel van 5 of 6 werd gebruikt. Er waren ook geen significante verschillen in kwaliteit van leven en algemene symptomen tussen de hypermobiele en de controlegroep. Een Finse studie vond een relatie tussen pijn en hypermobiliteit, maar alleen bij follow-up na 4 jaar, niet bij aanvang of na 1 jaar follow-up. Een Britse studie rapporteerde dat hypermobiliteit van gewrichten het risico op matig hinderlijke pijn aan het bewegingsapparaat verhoogt bij de schouder, knie en enkel, maar niet op andere plaatsen zoals de wervelkolom, ellebogen, handen en heupen. De effectgroottes waren relatief klein (odds ratio’s tussen 1,68 en 1,84), en toen de auteurs keken naar pijnintensiteitsscores of pijn die interfereert met dagelijkse activiteiten, vonden ze geen significante verschillen. Een meer recente Deense studie rapporteerde dat hypermobiliteit van de gewrichten geen voorspellende waarde had voor nek- en rugpijn.
Studies on adults are scarce. Two of the largest studies used a 5-item questionnaire to assess joint hypermobility. Because participants had to assess hypermobility themselves, these studies are at risk of various reporting biases (e.g., participants who report symptoms might be more likely to also report other conditions such as hypermobility). One survey in the UK found that hypermobile individuals were significantly more likely to report pain, but the difference was small: 18.5% versus 15.8% in controls. In the statistical models used, hypermobility accounted for less than 1% of the variability in pain. The authors concluded:
Studies bij volwassenen zijn schaars. Twee van de grootste studies gebruikten een vragenlijst met 5 items om hypermobiliteit van gewrichten te beoordelen. Omdat deelnemers hypermobiliteit zelf moesten beoordelen, lopen deze studies het risico op verschillende vertekeningen in de rapportage (deelnemers die symptomen rapporteren, hebben bijvoorbeeld meer kans om ook andere aandoeningen zoals hypermobiliteit te rapporteren). Uit één onderzoek in het Verenigd Koninkrijk bleek dat hypermobiele personen significant vaker pijn rapporteerden, maar het verschil was klein: 18,5% versus 15,8% bij de controles. In de gebruikte statistische modellen was hypermobiliteit verantwoordelijk voor minder dan 1% van de variabiliteit in pijn. De auteurs concludeerden: “De relatie was relatief bescheiden en kan worden verklaard door ongemeten verstorende factoren zoals psychologische distress.” [distress duidt op onaangename emoties omtrent fysieke symptomen, waarbij die emoties de symptomen negatief beïnvloeden, red.] Een vergelijkbare studie op basis van vragenlijsten werd gedaan in Denemarken met 1006 deelnemers. 30% van de deelnemers had hypermobiliteit, zoals beoordeeld met de vragenlijst met 5 items. De score voor levenskwaliteit was lager bij hypermobiele mensen dan in de controlegroep, maar het verschil was klein: een score van 80 versus 85 op 100. Een derde onderzoek beoordeelde de Beighton-score (0-9) bij jongvolwassenen in Florida. De auteurs melden dat “er geen verschil was in het percentage respondenten dat chronische gewrichtspijn rapporteerde in de drie categorieën van Beighton-scores (respectievelijk 11,9%, 16,1% en 12,9% van de respondenten met Beighton scores van 0, 1-4 en 5-9)”.
Concluderend is er op dit moment geen betrouwbaar bewijs dat hypermobiliteit geassocieerd is met pijn en invaliditeit. De meeste studies vonden geen of slechts een klein tot verwaarloosbaar verschil in pijnuitkomsten tussen mensen die hypermobiel zijn en mensen die dat niet zijn. De literatuur is echter beperkt, vooral bij volwassenen, waar de grootste studies zich baseren op zelfbeoordeling van hypermobiliteit. De meeste studies richten zich ook op het deel dat pijn rapporteert in plaats van de pijnintensiteit of meer specifieke metingen van invaliditeit.
Bovendien tonen bovenstaande onderzoeken aan dat hypermobiliteit en wijdverspreide pijn veel voorkomen. In een Australisch onderzoek had 18,6% van de adolescenten gegeneraliseerde hypermobiliteit van de gewrichten, zelfs wanneer een Beighton-score van 6 of hoger als drempel werd gebruikt. Chronische wijdverspreide pijn heeft ook een prevalentie van ongeveer 10% in de algemene bevolking. Vrouwen hebben een grotere kans op hypermobiele gewrichten en wijdverspreide pijn dan mannen, maar zelfs als we aannemen dat er geen relatie is tussen de twee, is er een grote groep patiënten met zowel hypermobiliteit als klachten aan het bewegingsapparaat. Het is niet ongewoon dat artsen veel van dit soort patiënten in hun kliniek zien. Dit betekent niet dat hypermobiliteit en pijn aan elkaar gerelateerd zijn. Diagnoses zoals JHS en HSD die op deze veronderstelling zijn gebaseerd, missen een solide wetenschappelijke basis.

Systemische kenmerken van hEDS
De diagnostische criteria voor hEDS zijn complexer omdat er aan drie voorwaarden moet worden voldaan (zie hieronder). Het eerste criterium is gegeneraliseerde gewrichtshypermobiliteit en het derde betreft het uitsluiten van andere ziekten die de symptomen zouden kunnen verklaren. Het tweede criterium vraagt naar verschillende tekenen en symptomen en bestaat uit drie delen: A, B en C, waarvan er twee aanwezig moeten zijn.
Het hebben van wijdverspreide pijn, wat het geval is bij ongeveer 10% van de bevolking, voldoet aan deel C. Aan deel B wordt voldaan als een eerstegraadsfamilielid (ouder, broer, zus of kind) hEDS heeft, wat bij sommigen het geval kan zijn omdat zowel gewrichtshypermobiliteit als pijn een genetische component hebben. De meeste personen die worden geëvalueerd voor de diagnose hEDS, zullen echter moeten voldoen aan deel A. Hiervoor is de aanwezigheid van 5 van de 12 klinische tekenen en afwijkingen vereist.
Tabel 2: hEDS-criteria uit 2017
De klinische diagnose hypermobiel EDS vereist de gelijktijdige aanwezigheid van alle drie de criteria.
Criterium 1 Gegeneraliseerde hypermobiliteit van de gewrichten
Beighton-hypermobiliteitsscore: ≥6 bij prepuberale kinderen en adolescenten ≥5 bij puberale mannen en vrouwen tot de leeftijd van 50 jaar ≥4 bij mannen en vrouwen ouder dan 50 jaar.
Als de Beighton-score één punt onder de leeftijds- en geslachtsspecifieke grenswaarde ligt, moeten ook twee of meer van de volgende worden geselecteerd om aan het criterium te voldoen:
- Kun je nu (of kon je ooit) je handen plat op de grond plaatsen zonder je knieën te buigen?
- Kun je nu (of kon je ooit) je duim buigen om je onderarm aan te raken?
- Heb je als kind je vrienden geamuseerd door je lichaam in vreemde vormen te draaien of kon je de spagaat doen?
- Ben je als kind of tiener meer dan eens uit de kom gegaan met je schouder of knieschijf?
- Beschouw je jezelf als “dubbelgeleed” of ongewoon flexibel?
Criterium 2 – Twee of meer van de volgende kenmerken (A, B of C) moeten aanwezig zijn:
Kenmerk A (er moeten er vijf aanwezig zijn):
- Ongewoon zachte of fluweelzachte huid
- Milde hyperextensibiliteit van de huid
- Onverklaarde striae distensae of rubae op de rug, liezen, dijen, borsten en/of buik bij adolescenten, mannen of prepuberale meisjes zonder een voorgeschiedenis van significante verandering in lichaamsvet of -gewicht
- Bilaterale piëzogene papels van de hiel
- Terugkerende of meervoudige abdominale hernia(‘s)
- Atrofische littekenvorming op ten minste twee plaatsen en zonder de vorming van echte papyraceuze of hemosiderische littekens zoals gezien bij klassieke EDS
- Bekkenbodem-, rectum- en/of baarmoederverzakking bij kinderen, mannen of niet-zwangere vrouwen zonder voorgeschiedenis van morbide obesitas of andere bekende predisponerende aandoening
- Gebitsproblemen waarbij de tanden scheef staan en een hoog of smal gehemelte
- Arachnodactylie, zoals gedefinieerd door een of meer van de volgende aandoeningen: Positief polsteken (teken van Walker) aan beide zijden, Positief duimteken (teken van Steinberg) aan beide zijden
- Als de armlengte en de lichaamslengte bekeken wordt, moet de verhouding gelijk zijn aan 1.05 of groter
- Mitralisklepprolaps licht of groter op basis van strikte echocardiografische criteria
- Verwijding (dilatatie) van de aortawortel met z-score ≥2
Kenmerk B:
- Positieve familieanamnese; een of meer eerstegraadsfamilieleden die onafhankelijk van elkaar voldoen aan de huidige criteria voor hypermobiel EDS
Kenmerk C (moet er ten minste één hebben):
- Musculoskeletale pijn in twee of meer ledematen, dagelijks terugkerend gedurende ≥ 3 maanden
- Chronische, wijdverspreide pijn gedurende ≥ 3 maanden
- Recidiverende gewrichtsluxaties of duidelijke gewrichtsinstabiliteit zonder trauma
Helaas vormen deze kenmerken een bonte verzameling die geen rechtvaardiging heeft. Sommige kenmerken, zoals arachnodactylie, zijn suggestief voor het Marfan-syndroom, een andere bindweefselaandoening. Van andere kenmerken is ooit gerapporteerd dat ze vaker voorkomen bij hEDS dan bij controles, maar het bewijs is niet overtuigend. Piëzogene papels, de kleine vetbultjes op de achterkant van de hiel, vormen een goed voorbeeld. De hEDS-criteria verwijzen naar één studie uit de jaren 1980 dat meer piëzogene papels bij hEDS-patiënten meldde dan bij controles, maar dit was alleen het geval voor pijnlijke piëzogene papels met een diameter van meer dan 0,2 cm. Dit lijkt een fout of misverstand van de auteurs van de hEDS-criteria uit 2017. Bilaterale piëzogene papels op de hiel zijn geen teken van een bindweefselaandoening. Twee studies hebben aangetoond dat de overgrote meerderheid (76%-80%) van de algemene bevolking ze heeft.
Andere kenmerken komen vaker voor dan hun medische woordenschat suggereert. Gebitsproblemen komen bijvoorbeeld voor bij ongeveer 30% tot 60% van de kinderen en adolescenten. Onverklaarbare striae of zwangerschapsstriemen komen vaak voor bij gezonde adolescenten en jongvolwassenen. In één studie werd dit bij 11% van de jonge mannen gevonden. Hernia’s treffen ongeveer 1 op de 10 mensen tijdens hun leven. In een Russische studie werd bijvoorbeeld bij 20% van de bevolking een abdominale hernia vastgesteld, met een recidiefpercentage van 30% tot 80% na herniaherstel. Atrofische littekens komen voor bij tot wel 87% van de patiënten met milde tot matige acne. Uit een onderzoek bleek dat bijna de helft van de acnepatiënten littekens had, waarvan de meerderheid (78%) atrofisch was. Mitralisklepprolaps is ook een veelvoorkomende aandoening, die 0,6% tot 2,4% van de algemene bevolking treft en meestal niet klinisch significant is bij patiënten met hEDS. Het bewijs over de vraag of mitralisklepprolaps vaker voorkomt bij hEDS-patiënten is tegenstrijdig, zoals de criteria van 2017 erkennen.
Andere kenmerken zoals ‘ongewoon zachte of fluweelachtige huid’, ‘smal gehemelte’ of ‘lichte hyperextensibiliteit van de huid’ zijn grotendeels subjectief. Uit een Chileens onderzoek bleek bijvoorbeeld dat 95% van de controlepersonen (paramedisch personeel) huidafwijkingen had. De auteurs rapporteren: “Huidafwijkingen werden gezien bij bijna alle patiënten en alle controles; sommige hiervan waren niet-specifiek, maar andere waren typisch, zoals een zachte, slappe, fluweelachtige huid en slechte heling (cheloïden en papyraceuze littekens).” Milde hyperextensibiliteit van de huid is ook niet-specifiek en werd in één studie aangetroffen bij 20% van de controlegroep.
Sommige studies hebben geen verband gerapporteerd tussen de hierboven genoemde kenmerken en gewrichtshypermobiliteit en stellen dat “Hogere BS [Beighton Scores] niet correleerden met een groter aantal systemische manifestaties.” Als beide manifestaties zouden zijn van dezelfde bindweefselziekte, zouden we een duidelijk verband verwachten.
Opgeblazen concepten
Samengevat is de diagnose hEDS gebaseerd op aspecifieke kenmerken die veel voorkomen en vaak goedaardig zijn bij de algemene bevolking. Patiënten met hypermobiliteit, chronische wijdverspreide pijn en vijf van de bovenstaande kenmerken kunnen de diagnose hEDS krijgen en te horen krijgen dat hun symptomen te wijten zijn aan een zeldzame bindweefselziekte. Voor de meeste van hen is dit waarschijnlijk niet het geval.
Op basis van de diagnosevereisten kunnen we verwachten dat de prevalentie van hEDS veel hoger is dan de vaak genoemde schatting van 1 op 5000. Helaas heeft geen enkele studie dit ooit getest. Er is geen enkel epidemiologisch onderzoek dat heeft vastgesteld hoeveel mensen aan de hEDS-criteria voldoen.** We hebben alleen kleinere studies die aanwijzingen gaven voor een opgeblazen prevalentie. In één studie werd bijvoorbeeld vastgesteld dat hEDS aanwezig was bij 18% van de patiënten met myalgische encefalomyelitis/ chronischevermoeidheidssyndroom (ME/cvs), maar ook bij 8% van de ‘gezonde’ controlegroep (het verschil was niet statistisch significant). In een brief aan de BMJ merkte een arts op:
“In de afgelopen 15 jaar is mijn aantal patiënten met het Ehlers-Danlossyndroom (EDS) toegenomen van twee per jaar tot twee per maand […] In totaal zou 40% van de vrouwen hypermobiel EDS kunnen vertonen als ze daarvoor kiezen. Dit maakt het nog geen bruikbare diagnose.”
Het is ook opmerkelijk hoe het scala aan symptomen dat aan JHS/hEDS wordt toegeschreven in de loop der jaren is toegenomen. Het hypermobiliteitssyndroom werd oorspronkelijk gedefinieerd als een goedaardige aandoening met milde en zelflimiterende musculoskeletale symptomen. Op dezelfde manier werd hEDS beschouwd als een “louter musculoskeletale aandoening met milde cutane complicaties”. Orthostatische intolerantie of invaliderende vermoeidheid werden niet genoemd totdat publicaties van Rowe et al. 1999 en Voermans et al. 2010 deze als belangrijke symptomen naar voren brachten. Tegenwoordig omvatten JHS en hEDS een breed scala aan klachten en aandoeningen, waaronder gastro-intestinale problemen, posturale orthostatische tachycardie, mestcelactivatie, craniocervicale instabiliteit, dunnevezelneuropathie, spierstijfheid, spanningshoofdpijn, gedragsstoornissen en bekkenbodemproblemen.
Het kan zijn dat de herkenning van deze symptomen in de loop der jaren is toegenomen. Sommigen stelden zelfs voor dat hEDS het “samenbindende concept is voor verschillende functionele somatische syndromen” of “de verborgen onderliggende diagnose voor veel chronische somatische pijnsyndromen”. Een meer plausibele verklaring is dat onderzoekers de diagnose hEDS hebben opgeblazen door patiënten op te nemen met onverklaarde symptomen en zonder duidelijke indicatie van bindweefselziekte.
Een Belgische studie vond dat orthostatische en gastro-intestinale klachten significant meer voorkwamen bij hEDS in vergelijking met klassieke en vasculaire EDS-types. De auteurs concludeerden: “Opmerkelijk genoeg leek het autonome symptoomprofiel van EDS-HT [een oudere naam voor hEDS] meer op fibromyalgie dan op de andere EDS-groepen.” Inderdaad, gebaseerd op het symptoomprofiel, de prevalentie, het vrouwelijk overwicht en het ontbreken van een moleculaire basis, lijkt hEDS meer op fibromyalgie en ME/cvs dan op andere EDS-types.
| Andere EDS-types | hEDS | |
| Prevalentie | (Heel) zeldzaam: < 0.005% | Vaak voorkomend > 0.02% |
| Oorzaak | Bekende genetische mutatie waarbij extracellulaire matrixeiwitten betrokken zijn. | Moleculaire basis onbekend, geen bewijs van bindweefselziekte. |
| Klinische kenmerken | Specifieke klinische symptomen zoals blauwe sclerae, slagaderlijke ruptuur, extreem hyperelastische huid, pseudotumoren, enz. | Gewone of vage kenmerken zoals hypermobiliteit van gewrichten, wijdverspreide chronische pijn, zachte huid, striae, tanden die over elkaar staan enz. |
| Vrouwelijk overwicht | Ca. 50-60% is vrouwelijk | Ca. 90% is vrouwelijk |
| Symptomen | Vaak gerelateerd aan fysieke afwijkingen zoals kyphoscoliose, orgaanruptuur, gemakkelijk blauwe plekken, enz. | Breed scala aan zeer invaliderende maar onverklaarbare symptomen, vergelijkbaar met ME/cvs en fibromyalgie |
Geen correlatie
Reumatologen zijn vaak sceptisch over de klinische waarde van hypermobiliteit. In een onderzoek uit 2001 onder Britse reumaconsulenten had bijna de helft van de respondenten twijfels over de impact van hypermobiliteitssyndromen op het leven van mensen en driekwart was sceptisch over een significante bijdrage aan de algehele last van reumatische aandoeningen.
Studies bij andere aandoeningen suggereren dat hypermobiliteit vaak een beperkte klinische waarde heeft. Uit een studie naar functionele maagdarmstoornissen bleek bijvoorbeeld dat “er geen significant verschil was in prevalentie van orthostatische intolerantie, OH [orthostatische hypotensie], en POTS [posturaal orthostatisch tachycardiesyndroom] tussen mensen met hypermobiliteit van de gewrichten en mensen zonder.” Onderzoeken naar fibromyalgie vonden geen verschil in pijnintensiteit tussen patiënten met of zonder hypermobiliteit en geen correlatie tussen Beighton-scores en tenderpoints (drukpunten). Uit een ander onderzoek naar functionele pijnstoornissen bleek dat de autonome functie vergelijkbaar was bij patiënten met en zonder hypermobiliteit. Een onderzoek naar maagklachten rapporteerde: “We identificeerden geen specifieke verschillen in de sensorimotorische functie van de maag tussen patiënten met en zonder JHS.”
ME/cvs-studies laten vergelijkbare resultaten zien. Hoewel sommige studies meer orthostatische problemen vonden bij ME/cvs-patiënten met hypermobiliteit versus personen zonder hypermobiliteit, vonden de meeste (voorbeelden hier, hier, hier, en hier) geen significante verschillen. Eén studie bijvoorbeeld concludeerde dat “het klinische belang van gegeneraliseerde hypermobiliteit van gewrichten twijfelachtig is” en dat “er geen bewijs werd geleverd dat het klinische belang van hypermobiliteit bij patiënten met CVS ondersteunt.” Een andere studie concludeerde dat gewrichtshypermobiliteit “niet geassocieerd was met andere klinische kenmerken van de ziekte.” Toegegeven, we kunnen niet veel concluderen uit dergelijke onderzoeken, maar ze suggereren wel dat hypermobiliteit en hEDS waarschijnlijk niet het verbindende concept zijn voor functionele syndromen.
Gelijkenis met POTS
Het probleem van hEDS is vergelijkbaar met dat van POTS (zie hiervoor onze eerdere blogpost over POTS). Beide diagnoses zijn gebaseerd op een onderliggende aanname van wat de symptomen van patiënten veroorzaakt, namelijk een bindweefselaandoening of autonome disfunctie. Dit in tegenstelling tot syndromen zoals ME/cvs, prikkelbaredarmsyndroom of fibromyalgie, die een klinisch beeld beschrijven zonder aannames te doen over de onderliggende oorzaken.
Terwijl POTS werd gebruikt als een restcategorie voor orthostatische symptomen zonder duidelijke autonome disfunctie, is hEDS het enige EDS-type waarvoor geen genetische mutatie is geïdentificeerd. In de literatuur over POTS en hEDS ontbreken ook epidemiologische studies met representatieve steekproeven van de algemene bevolking. Kenmerken van hypermobiliteit en orthostatische tachycardie komen vaker voor en zijn goedaardiger dan beide diagnoses doen vermoeden (beide symptomen komen ook vaker voor bij jonge vrouwen, wat misschien verklaart waarom sommigen denken dat er een verband is tussen POTS en hEDS).
We hopen dat de bindweefselhypothese klopt voor ten minste een subgroep van patiënten met hEDS en dat de lopende HEDGE-studie (Hypermobile Ehlers-Danlos Genetic Evaluation) nieuwe genetische mutaties zal identificeren. Zolang er echter geen robuust bewijs is, kan het diagnosticeren van hEDS lijken op het achter de wagen spannen van het paard.
POTS en hEDS zijn beide speculatieve theorieën zonder robuust bewijs, die zelden in twijfel worden getrokken omdat ze worden gemaskeerd als een reeds vastgestelde diagnose. Het in twijfel trekken van de onderliggende theorie achter POTS of hEDS voelt daarom als het verwerpen van de diagnose zelf, wat sommige patiënten verontrustend of beledigend vinden. Wij geloven echter dat het belangrijk is om het bewijs kritisch te beoordelen, want als deze theorieën niet kloppen, zijn het de patiënten die de prijs betalen voor deze fouten.
hEDS en POTS zijn zeker niet de enige diagnoses die op deze manier werken. Andere voorbeelden zijn mestcelactivatiestoornis (MCAS), centrale sensitiviteitssyndroom, chronische Lyme en Bodily Distress Syndrome. In toekomstige blogposts hopen we dieper in te gaan op dit fenomeen van speculatieve theorieën verpakt als diagnoses.
Opmerkingen
* Een interessante studie uit 2024 vond bewijs voor een gemeenschappelijk extracellulair matrixfragmentatiepatroon in het plasma van hEDS- en HSD-patiënten dat niet werd gezien bij andere EDS-types of reumatische aandoeningen. De bevindingen zijn echter niet gerepliceerd. Voor een kritische bespreking van dit artikel zie het Science for ME-forum.
** De schattingen van de prevalentie van hEDS zijn gebaseerd op elektronische registers die routinematig gegevens over eerstelijnszorg en ziekenhuisopnames verzamelen. Deze kunnen de prevalentie van hEDS en JHS onderschatten als patiënten ongediagnosticeerd blijven.
© ME/CFS Skeptic, 16 oktober 2024. Vertaling admin, redactie NAHdine, ME-gids.
Commentaar Svetlana Blitshteyn van Dysautonomia Clinic:
Confirmation bias is big here: someone who sets out to prove a lack of association can certainly find some papers in support. 🙂
— S Blitshteyn MD, FAAN, Dysautonomia Clinic (@dysclinic) October 16, 2024
I think the onus is on those claiming a relationship with joint hypermobility, diagnosing patients with JHS/hEDS and saying that they have a connective tissue disease.
— ME/CFS Skeptic (@mecfsskeptic) October 17, 2024
There should be reliable evidence for this but we could not find it.





