
Onderzoekers aan de University of Oklahoma hebben een studie gepubliceerd over het eerste diermodel van POTS, een essentiële stap in het bevestigen of een aandoening al dan niet een auto-immuunziekte is. Bovendien melden ze dat antistoffen die vergelijkbaar zijn met deze die gevonden zijn bij POTS, tachycardie veroorzaken bij konijnen. Misschien nog belangrijker is dat ze een potentieel nieuw geneesmiddel geïdentificeerd hebben dat het effect van de antilichamen remt.
Deze studie toont voor de eerste keer een rol van adrenerge auto-immuniteit aan in de pathofysiologie van POTS in twee gerelateerde diermodellen.
De studie toon ook aan dat de effecten van adrenerge autoantistoffen grotendeels omgekeerd worden met behulp van een samenstelling die de autoantistoffen blokkeert, en die ontwikkeld werd door de onderzoekers van de University of Oklahoma.
Het werk werd ondersteund door een subsidie van het POTS Research Fund van Dysautonomia International.
Lees het onderzoeksartikel hier: www.ahajournals.org/doi/10.1161/JAHA.119.013006 . ME-gids biedt u de vertaling van het abstract aan.
Lees dan ook het editoriaal dat het belang van de bevindingen benadrukt: www.ahajournals.org/doi/10.1161/JAHA.119.014084. Hieronder kunt u de vertaling ervan lezen.
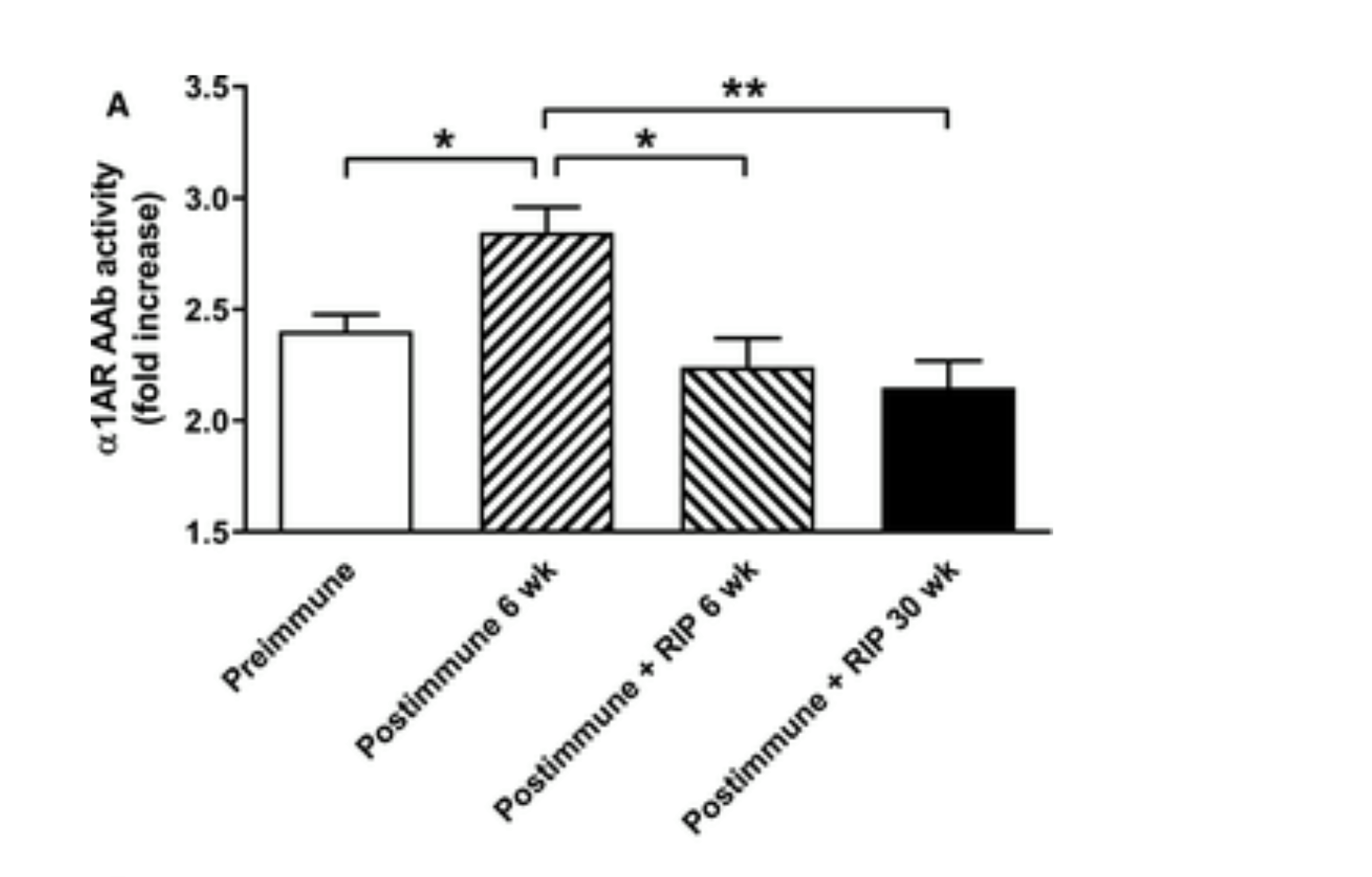
Merk op dat RIP in de afbeelding hierboven staat voor retro-inverso peptide. De RIP in deze studie is de samenstelling die University of Oklahoma ontwikkeld heeft, en waarvan zij hopen dat ze ooit gebruikt zal kunnen worden als behandeling bij POTS-patiënten om de effecten van deze antilichamen te blokkeren. Er is veel meer onderzoek nodig voor de samenstelling gebruikt kan worden bij mensen, maar ze gaan zo snel als mogelijk vooruit.
© Facebook Dysautonomia International
Adrenerge door autoantistoffen geïnduceerd Posturaal Tachycardiesyndroom bij konijnen
Hongliang Li , Gege Zhang, Liping Zhou,Zachary Nuss, Marci Beel, Brendon Hines, Taylor Murphy, Jonathan Liles, Ling Zhang,David C. Kem, and Xichun Yu
Origineel gepubliceerd op 24 september 2019 https://doi.org/10.1161/JAHA.119.013006 Journal of the American Heart Association. 2019;8:e013006
Abstract
Achtergrond
Previous studies have demonstrated that functional autoantibodies to adrenergic receptors may be involved in the pathogenesis of postural tachycardia syndrome. The objective of this study was to examine the impact of these autoantibodies on cardiovascular responses to postural changes and adrenergic orthosteric ligand infusions in immunized rabbits.
Eerdere studie hebben aangetoond dat functionele autoantistoffen tegen adrenerge receptoren mogelijk betrokken zijn bij de pathogenese van posturaal orthostatisch tachycardiesyndroom. Het doel van deze studie was om de impact van deze autoantistoffen te onderzoeken op cardiovasculaire reacties op posturale veranderingen en adrenerge orthosterische ligandinfusies bij geïmmuniseerde konijnen.
Methoden en resultaten
Acht witte Nieuw-Zeelandse konijnen werden geco-immuniseerd met peptiden van de α1‐adrenerge receptor en de β1‐adrenerge receptor (β1AR). Tilttest en afzonderlijke adrenerge agonistische infusiestudies werden uitgevoerd bij dieren bij bewustzijn voor en na immunisatie en daaropvolgende behandeling met epitoop-mimetische peptideremmers. 6 weken na immunisatie was er een grotere procentuele verhoging in hartslag bij het kantelen in vergelijking met vóór immunisatie. Er werd geen significant verschil in bloeddrukrespons waargenomen bij kantelen. De hartslagrespons op infusie van de β‐adrenoceptoragonist isoproterenol was significant verbeterd bij geïmmuniseerde dieren, wat een positief allosterisch effect van β1AR-antistoffen suggereert. De bloeddrukrespons op infusie van de α1‐adrenerge receptoragonist fenylefrine daarentegen was verzwakt bij geïmmuniseerde dieren, wat wijst op een negatief allosterisch effect van de α1‐adrenerge receptorantistoffen. Injecties van antistofneutraliserende peptides onderdrukten de posturale tachycardie en keerden de veranderde hartslag- en bloeddrukrespons om tot orthosterische ligandinfusies bij geïmmuniseerde dieren op 6 en 30 weken. Antilichaamproductie en –suppressie werd bevestigd met bio-analyses in vitro.
Conclusies
Het differentieel allosterisch effect van α1‐adrenerge receptor and β1AR autoantistoffen zou leiden tot een hyperadrenerge staat en overstimulatie van cardiale β1AR. Deze gegevens ondersteunen bewijs van een auto-immune basis voor posturaal orthostatisch tachycardiesyndroom.
Zie Editoriaal Miller en Doherty
Klinisch perspectief
Wat is er nieuw?
- Deze studie toont voor de eerste keer een rol aan van adrenerge auto-immuniteit in de pathofysiologie van posturaal tachycardiesyndroom bij 2 gerelateerde modellen in vivo.
- De effecten van adrenerge autoantistoffen worden grotendeels omgekeerd met behulp van selectieve afleidingspeptideremmers voor de autoantistoffen.
Wat zijn de klinische implicaties?
- Deze gegevens ondersteunen het idee dat door autoantistoffen gemedieerde veranderingen in cardiovasculaire responsen op catecholamines bijdragen aan de pathogenese van het posturaal tachycardiesyndroom.
- Farmacologische suppressie van adrenerge autoantistoffen kunnen een therapeutisch voordeel hebben bij het posturaal tachycardiesyndroom.
Citeren?
Li H, Zhang G, Zhou L, Nuss Z, Beel M, Hines B, Murphy T, Liles J, Zhang L, Kem DC, Yu X. Adrenergic Autoantibody‐Induced Postural Tachycardia Syndrome in Rabbits. Journal of the American Heart Association. 2019;8:e013006 https://doi.org/10.1161/JAHA.119.013006
Een sprong vooruit: het eerste diermodel van auto-immune posturaal orthostatisch tachycardiesyndroom
Amanda J. Miller en Taylor A. Doherty
Origineel gepubliceerd op 24 september 2019 https://doi.org/10.1161/JAHA.119.014084 Journal of the American Heart Association. 2019;8:e014084
Abstract
Zie artikel Li et al. (cf. supra)
Posturaal orthostatisch tachycardiesyndroom (POTS) is een chronische vorm van orthostatische intolerantie die dagelijkse symptomen uitlokt zoals ijlhoofdigheid, vermoeidheid, zwakte, en misselijkheid, wat de levenskwaliteit aanzienlijk kan beïnvloeden. [1] POTS wordt gedefinieerd door de aanwezigheid van deze symptomen en orthostatische tachycardie (een verhoging in hartslag vanuit ligstand van ten minste 30 slagen per minuut bij volwassenen of 40 slagen per minuut bij jongeren na 10 minuten staan of kanteling). [2] De oorzaak van POTS is momenteel onbekend en waarschijnlijk heterogeen. POTS treft voornamelijk premenopauzale vrouwen, en het begin wordt vaak veroorzaakt door een gebeurtenis zoals een virale ziekte of een letsel. [1]
Er is steeds meer bewijs dat een auto-immune basis voor POTS suggereert. [3] Verschillende studies hebben de aanwezigheid van autoantistoffen bij POTS onderzocht en hun effecten op cholinerge en adrenerge receptoren. [3] Er werden lage niveaus van antilichamen tegen ganglionische cholinerge receptoren gevonden bij een minderheid van mensen met POTS (5%-29%). Er werden echter vergelijkbaar lage niveaus van deze antilichamen gevonden bij gezonde vrijwilligers en bij mensen met niet-gerelateerde auto-immuunziekten. Hoewel de aanwezigheid van cholinerge receptorantilichamen bij POTS zowel lage sensitiviteit als specificiteit hebben, kunnen functionele antilichamen tegen adrenerge receptoren een potentiële biomarker zijn voor het diagnosticeren van POTS. [3] Eén groep heeft consequent antilichamen gevonden die binden aan adrenerge receptoren en ze activeren bij alle patiënten met POTS die getest zijn uit 2 verschillende landen. [4][5] Deze studies vonden antilichamen die de β1-adrenerge receptor activeren bij de meeste deelnemers met POTS (n=28/32), en een kleinere subgroep van deelnemers met POTS was positief voor antilichamen die β2-adrenerge receptoren activeren en werken als partiële agonisten/antagonisten voor α1-receptoren. [4][5] Dit zijn echter kleine studies en het is niet bekend of de meeste of alle patiënten met POTS functionele antilichamen hebben tegen de α1- en β-adrenerge receptoren en hoeveel gezonde personen vergelijkbare autoantistoffen hebben. Verder onderzoek naar de prevalentie van deze adrenerge autoantistoffen bij POTS door andere groepen in grotere steekproeven is nodig om deze bevindingen te bevestigen.
Autoantistoffen tegen adrenerge receptoren kunnen bijdragen aan de pathyfysiologische kenmerken van POTS, omdat adrenerge receptoren belangrijke regulatoren van bloeddruk en hartslag zijn. [6] Bovendien hebben patiënten met POTS verminderde door α1-adrenerge receptor geïnduceerde vasoconstrictie en versterkte door β1-adrenerge receptor geïnduceerde tachycardie. [6][7] Hoe de niveaus van adrenerge antilichamen bij POTS gerelateerd zijn aan de ernst van de symptomen of het ziekteverloop, is niet onderzocht. Een eerdere studie door Li et al. [4] vond dat autoantistoffen in serum van POTS-patiënten functionele allosterische adrenerge effecten in vitro induceren in geïsoleerde slagaders bij ratten. [4] In deze studie werkten antilichamen tegen de α1-adrenerge receptor als antagonisten in door fenylefrine-geïnduceerde vasoconstrictie-assays en autoantistoffen tegen de β1- of β2-adrenerge receptoren verhoogden de respons op de niet-selectieve β-agonist, isoproterenol. [4]
In dit nummer van het Journal of the American Heart Assocation (JAHA), “Adrenergic Autoantibody‐Induced Postural Tachycardia Syndrome in Rabbits” [Adrenerge door autoantistoffen geïnduceerd Posturaal Tachycardiesyndroom bij konijnen] door Li et al. [8] bouwt voort op het eerdere werk van de groep over de rol van adrenerge autoantistoffen bij POTS. In deze nieuwe studie ontwikkelden de auteurs met adrenerge receptorpeptide geïmmuniseerde konijnen om de rol van adrenerge autoantistoffen in vivo te onderzoeken. De auteurs onderzochten de functionele rol van deze adrenerge autoantistoffen, die functioneel vergelijkbaar zijn met deze die geïsoleerd zijn uit het serum van POTS-patiënten, en of de antilichamen in vivo verwijderd konden worden met behulp van afleidingspeptideremmers. De belangrijkste bevindingen van deze studie zijn dat de adrenerge autoantistoffen een POTS-achtig fenotype induceerden bij konijnen, waaronder verergering van orthostatische tachycardie en onderdrukking van adrenerge receptordisfunctie door selectieve verwijdering van de antistoffen in vivo.
Deze studie biedt 2 belangrijke stappen vooruit voor POTS-onderzoek. Ten eerste is de ontwikkeling van een diermodel van POTS, gebaseerd op een auto-immune oorzaak, cruciaal voor toekomstig POTS-onderzoek. Eén uitdaging bij het uitvoeren van mechanistische studies bij POTS is dat de patiënten heterogene oorzaken en pathofysiologische kenmerken vertonen. [6] Het gebrek aan biomarkers en gestandaardiseerde fenotypische studies maken het moeilijk om specifieke populaties met POTS te rekruteren en goed te karakteriseren. Omdat POTS geen duidelijke oorzaak heeft, zijn er voor toekomstige mechanistische studies diermodellen nodig die de pathofysiologische veranderingen nabootsen. Andere knaagdiermodellen, zoals het ophangen van de achterpoten om deconditonering te simuleren, zijn voorgesteld voor gebruik bij POTS. Hoewel veel patiënten met POTS symptomen hebben van fysieke deconditionering, zoals inspanningsintolerantie en verminderde cardiale massa, [6] induceert deconditionering niet specifiek POTS bij de meeste mensen of dieren. Dus de bevinding dat immunisatie van konijnen met adrenerge receptorpeptiden POTS-achtige fysiologische kenmerken in vivo kan induceren, is een belangrijke vooruitgang voor het veld. De bevindingen door Li et al. [8] bieden een nieuw diermodel van POTS dat homogeen en omkeerbaar is. Het is echter onduidelijk hoe vergelijkbaar dit model is met de patiëntenpopulatie met POTS. Zoals hierboven vermeld, is de exacte prevalentie en klinische relevantie van deze antistoffen nog steeds onduidelijk. Een andere potentieel probleem is hoe specifiek deze antistoffen voor POTS zijn, aangezien anti-adrenerge recepterantistoffen gevonden zijn bij verschillende hart- en vaatziekten, evenals bij chronisch vermoeidheidssyndroom, dementie, en oogziekten. [3][9][10][11][12] Hoewel de autoantistoffen duidelijk functioneel zijn in het konijnenmodel, is het onduidelijk of de aanwezigheid van adrenerge autoantistoffen bij deelnemers met POTS een neveneffect is van het primaire ziekteproces of dat ze centraal pathogeen zijn. Er zijn ook andere ziekten waarbij nevenantistoffen gevonden worden, zoals reumatoïde artritis, waarin autoantilichamen aanwezig zijn ruim voordat pathologische veranderingen optreden en zelfs in remissie blijven bestaan. [13] Tot slot is er controverse omtrent of een viervoetig diermodel een orthostatisch syndroom zoals POTS accuraat kan modelleren. Hoewel de konijnen geïnjecteerd met adrenerge autoantistoffen overdreven orthostatische tachycardie hadden tijdens het opwaarts kantelen in vergelijking met controles, is rechtop staan niet natuurlijk voor knaagdieren en bootste het geen orthostatische stress na bij mensen.
De tweede belangrijke bijdrage van dit werk is, dat het een gerichte immuuntherapie tot stand brengt als een potentieel therapeutisch middel tegen POTS. Helaas is een groot percentage van patiënten met POTS aanzienlijk geïnvalideerd, ondanks huidige behandelingen. Schattingen suggereren dat tot 25% arbeidsongeschikt is of niet naar school kan, en morbiditeit staat op hetzelfde niveau als hartfalen in het eindstadium en chronische obstructieve longziekte (COPD). [14][15] Dus als gemeenschap is er een sterke behoefte om zowel de mechanismen beter te begrijpen als nieuwe behandelingen in overweging te nemen, ondanks risico’s bij een subgroep van patiënten. Het artikel door Li et al. [8] biedt bewijs dat immuuntherapie POTS-achtige fysiologische kenmerken kan voorkomen, althans bij konijnen. De studie toonde aan dat orthostatische tachycardie in het konijnenmodel van POTS onderdrukt kon worden door ervoor te zorgen dat de adrenerge autoantistoffen zich niet bonden aan hun doelwitten in vivo, door gebruik te maken van stabiele oplosbare peptidenabootsers. Het gebruik van immunotherapie bij POTS is momenteel controversieel, hoewel casusverslagen en casusreeksen aangetoond hebben dat immuuntherapie symptomen van POTS verbetert bij patiënten met comorbide auto-immuunziekten en therapieresistente ziekten. [3][15][16] Er is ook een lopende gerandomiseerde gecontroleerde studie om de doeltreffendheid van intraveneuze immunoglobuline bij POTS te evalueren (ClinicalTrials.gov Identificatiecode: NCT03919773), wat een eerste stap is in het begrijpen van de rol van auto-immuniteit bij POTS. Zoals bij elke immuuntherapie, moeten de risico’s en potentiële voordelen geëvalueerd worden. In de Verenigde Staten bestaat immuuntherapie gericht op autoantistoffen, grotendeels uit therapeutische plasma-uitwisseling, intraveneuze immunoglobulines, en/of B-celdepletie. Geen van deze behandelingen is echter ideaal voor het behandeling van auto-immunziekten waaronder auto-immune POTS. Therapeutische plasma-uitwisseling omvat het uitwisselen van grote hoeveelheid van plasma met albumine, waardoor, na meerdere behandelingen, autoantistoffen verwijderd worden, hoewel het niet gericht is op het verlagen van de autoantilichaamproductie. Risico’s van plasma-uitwisseling omvatten hypotensie, coagulopathieën, complicaties van centraal veneuze toegang en potentiële reacties op reagentia. Intraveneuze immunoglobuline richt zich op auto-immuniteit via meerdere mechanismen, waaronder anti-idiotype binding, Fc-γ-signalering, en dilutioneel katabolisme van autoantilichamen en endogene immunoglobuline Gs. [17] Immunoglobuline G antilichamen worden echter verspreid doorheen het hele lichaam, en verwijdering uit plasma kan de totale lichaamsniveaus slechts gedeeltelijk verlagen. Intraveneuze immunoglobulines hebben bijwerkingen, zoals inflammatoire reacties, hemolytische anemie, en aseptische meningitis, waarvoor patiënten met POTS anekdotisch gevoeliger kunnen zijn. B-celdepletietherapieën, waaronder rituximab, richten zich op CD20+ B-cellen om de B-celpopulaties te verwijderen die voorlopers zijn van antistofproducerende plasmacellen. Als enkelvoudig agens heeft rituximab een sterk veiligheidsprofiel, hoewel infecties en ernstige reacties (vooral als reactie op de eerste infusie) voorkomen. [18] Eén probleem met B-celdepletietherapie is dat langlevende antilichaamproducerende plasmacellen, die niet CD20 tot expressie brengen, mogelijk niet beïnvloed worden door B-celdepletietherapie. In andere landen is immunoadsorptie gebruikt om selectief specifieke adrenerge receptorautoantistoffen met enige doeltreffendheid te verwijderen bij ziekten, waaronder cardiovasculaire aandoeningen, chronisch vermoeidheidssyndroom, dementie en glaucoom. [9][11][12][19] Antigeenspecifieke immunoadsorptie is vergelijkbaar met therapeutische plasma-uitwisseling, maar het serum van de patiënt passeert door een kolom die liganden in de vaste fase bevat die alleen aan autoantilichamen binden, en de rest van het plasma wordt teruggestuurd naar de patiënt. Immunoadsorptie kan dus een potentieel veelbelovende therapeutische benadering zijn om zich selectief te richten op autoantilichamen bij auto-immuunvormen van POTS, en is een gelijkaardige strategie die gebruikt wordt in het rapport van Li et al. [8]
Over het algemeen hebben Li et al. [8] vooruitgang geboekt op het gebied van onderzoek naar POTS door een in vivo diermodel van auto-immune POTS te ontwikkelen. POTS is een syndroom dat veel baat zou kunnen hebben bij een diermodel voor mechanistisch en therapeutisch onderzoek. De vraag blijft hoe goed dit konijnenmodel van POTS de heterogene patiëntenpopulatie vertegenwoordigt en of het zal bijdragen aan verdere vooruitgang in de richting van nieuwe therapieën voor POTS.
Belangenverstrengeling
Geen.
Referenties
- 1 Shaw BH, Stiles LE, Bourne K, Green EA, Shibao CA, Okamoto LE, Garland EM, Gamboa A, Diedrich A, Raj V, Sheldon RS, Biaggioni I, Robertson D, Raj SR. The face of postural tachycardia syndrome—insights from a large cross‐sectional online community‐based survey. J Intern Med. 2019. Mar 12. [Epub ahead of print]. Crossref Medline Google Scholar
- 2 Sheldon RS, Grubb BP, Olshansky B, Shen WK, Calkins H, Brignole M, Raj SR, Krahn AD, Morillo CA, Stewart JM, Sutton R, Sandroni P, Friday KJ, Hachul DT, Cohen MI, Lau DH, Mayuga KA, Moak JP, Sandhu RK, Kanjwal K. 2015 Heart Rhythm Society expert consensus statement on the diagnosis and treatment of postural tachycardia syndrome, inappropriate sinus tachycardia, and vasovagal syncope. Heart Rhythm. 2015; 12:e41–e63. Crossref Medline Google Scholar
- 3 Vernino S, Stiles LE. Autoimmunity in postural orthostatic tachycardia syndrome: current understanding. Auton Neurosci. 2018; 215:78–82. Crossref Medline Google Scholar
- 4 Li H, Yu X, Liles C, Khan M, Vanderlinde‐Wood M, Galloway A, Zillner C, Benbrook A, Reim S, Collier D, Hill MA, Raj SR, Okamoto LE, Cunningham MW, Aston CE, Kem DC. Autoimmune basis for postural tachycardia syndrome. J Am Heart Assoc. 2014; 3:e000755. DOI: 10.1161/JAHA.113.000755 . Link Google Scholar
- 5 Fedorowski A, Li H, Yu X, Koelsch KA, Harris VM, Liles C, Murphy TA, Quadri SMS, Scofield RH, Sutton R, Melander O, Kem DC. Antiadrenergic autoimmunity in postural tachycardia syndrome. Europace. 2017; 19:1211–1219. Crossref Medline Google Scholar
- 6 Arnold AC, Ng J, Raj SR. Postural tachycardia syndrome—diagnosis, physiology, and prognosis. Auton Neurosci. 2018; 215:3–11. Crossref Medline Google Scholar
- 7 Stewart JM, Munoz J, Weldon A. Clinical and physiological effects of an acute alpha‐1 adrenergic agonist and a beta‐1 adrenergic antagonist in chronic orthostatic intolerance. Circulation. 2002; 106:2946–2954. Link Google Scholar
- 8 Li H, Zhang G, Zhou L, Nuss Z, Beel M, Hines B, Murphy T, Liles J, Zhang L, Kem DC, Yu X. Adrenergic autoantibody‐induced postural tachycardia syndrome in rabbits. J Am Heart Assoc. 2019; 8:e013006. DOI: 10.1161/JAHA.119.013006 . Link Google Scholar
- 9 Scheibenbogen C, Loebel M, Freitag H, Krueger A, Bauer S, Antelmann M, Doehner W, Scherbakov N, Heidecke H, Reinke P, Volk HD, Grabowski P. Immunoadsorption to remove β2 adrenergic receptor antibodies in chronic fatigue syndrome CFS/ME. PLoS One. 2018; 13:e0193672. Crossref Medline Google Scholar
- 10 Thyrian JR, Hertel J, Schulze LN, Dorr M, Pruss H, Hempel P, Bimmler M, Kunze R, Grabe HJ, Teipel S, Hoffmann W. Prevalence and determinants of agonistic autoantibodies against alpha1‐adrenergic receptors in patients screened positive for dementia: results from the population‐based DelpHi‐Study. J Alzheimers Dis. 2018; 64:1091–1097. Crossref Medline Google Scholar
- 11 Junemann A, Hohberger B, Rech J, Sheriff A, Fu Q, Schlotzer‐Schrehardt U, Voll RE, Bartel S, Kalbacher H, Hoebeke J, Rejdak R, Horn F, Wallukat G, Kunze R, Herrmann M. Agonistic autoantibodies to the beta2‐adrenergic receptor involved in the pathogenesis of open‐angle glaucoma. Front Immunol . 2018; 9:145. Crossref Medline Google Scholar
- 12 Hempel P, Heinig B, Jerosch C, Decius I, Karczewski P, Kassner U, Kunze R, Steinhagen‐Thiessen E, Bimmler M. Immunoadsorption of agonistic autoantibodies against alpha1‐adrenergic receptors in patients with mild to moderate dementia. Ther Apher Dial. 2016; 20:523–529. Crossref Medline Google Scholar
- 13 Boeters DM, Burgers LE, Toes RE, van der Helm‐van Mil A. Does immunological remission, defined as disappearance of autoantibodies, occur with current treatment strategies? A long‐term follow‐up study in rheumatoid arthritis patients who achieved sustained DMARD‐free status. Ann Rheum Dis. 2019 Aug 14. pii: annrheumdis‐2018‐214868. DOI: 10.1136/annrheumdis‐2018‐214868 . [Epub ahead of print]. Crossref Google Scholar
- 14 Benrud‐Larson LM, Dewar MS, Sandroni P, Rummans TA, Haythornthwaite JA, Low PA. Quality of life in patients with postural tachycardia syndrome. Mayo Clin Proc. 2002; 77:531–537. Crossref Medline Google Scholar
- 15 Zadourian A, Doherty TA, Swiatkiewicz I, Taub PR. Postural orthostatic tachycardia syndrome: prevalence, pathophysiology, and management. Drugs. 2018; 78:983–994. Crossref Medline Google Scholar
- 16 Schofield JR, Chemali KR. Intravenous immunoglobulin therapy in refractory autoimmune dysautonomias: a retrospective analysis of 38 patients. Am J Ther. 2019; 26:570–582. Crossref Medline Google Scholar
- 17 Chaigne B, Mouthon L. Mechanisms of action of intravenous immunoglobulin. Transfus Apher Sci. 2017; 56:45–49. Crossref Medline Google Scholar
- 18 Tavakolpour S, Alesaeidi S, Darvishi M, GhasemiAdl M, Darabi‐Monadi S, Akhlaghdoust M, Elikaei Behjati S, Jafarieh A. A comprehensive review of rituximab therapy in rheumatoid arthritis patients. Clin Rheumatol. 2019 Aug 1. DOI: 10.1007/s10067‐019‐04699‐8 . [Epub ahead of print]. Crossref Medline Google Scholar
- 19 Becker NP, Goettel P, Mueller J, Wallukat G, Schimke I. Functional autoantibody diseases: basics and treatment related to cardiomyopathies. Front Biosci (Landmark Ed). 2019; 24:48–95. Crossref Medline Google Scholar
© Miller & Doherty, 2019. Vertaling Zuiderzon, redactie Abby, ME-gids.
Lees ook
- Belangrijke sprong vooruit! Diermodel en succesvolle behandeling. (Dit is POTS.nl, 30 september 2019)





