Auto-immune autonome ganglionopathie is een zeer zeldzame ziekte. Waarom het dan aan bod laten komen in een blog over ME/cvs en posturaal orthostatisch tachycardiesyndroom (POTS)? Omdat het een vooruitblik op de toekomst zou kunnen zijn. Al deze ziekten worden gekenmerkt door problemen met het autonoom zenuwstelsel (AZS). Hoewel we vrij veel weten over het AZS (en andere) problemen bij deze ziekten, weten we nog steeds niet waarom ze zijn opgetreden. Auto-immuniteit is een mogelijkheid voor elk van deze ziekten.
Het AZS heeft invloed op de bloedstroom, vertering, het immuunsysteem, de hartslag, slaap, etc. Wanneer het lichaam op een stressor moet reageren, wordt het vecht- of vluchtsysteem (sympathisch zenuwstelsel, SZS) geactiveerd. Wanneer de stressor weg is, brengt het ‘rust- en verteringssysteem’ (parasympathisch zenuwstelsel, PZS) het lichaam terug naar normaal functioneren. Bij ME/cvs, POTS is het vecht- en vluchtsysteem ongewoon actief.
Er was een lezing over auto-immune autonome ganglionopathie (AAG) door Steven Vernino op de laatste conferentie van Dysautonomia International.
Auto-immune autonome ganglionopathie (AAG) is interessant omdat het aantoont hoe het immuunsysteem een enorme dreun kan verkopen aan het autonoom zenuwstelsel. Gezien de vele mensen met ME/cvs en POTS bij wie de ziekte uitgelokt werd door een infectie, d.w.z. een immuunrespons – is dit een intrigerend feit.
Steve Vernino vertelde hoe AAG bij een vijftigjarige vrouw met een verkoudheid begon! Vier dagen later werd ze opgenomen in het ziekenhuis met ernstige misselijkheid, buikpijn, tintelingen, wazig zicht en duizeligheid. Haar bloeddruk deed rare dingen: liggend was haar bloeddruk hoognormaal, maar rechtstaand zakte die tot 80/56 (!).
Aangezien het AZS de bloeddruk reguleert, suggereerden deze vreemde bloeddrukwaarden dat haar AZS niet goed functioneerde. Andere tekenen – droge mond, vergrote pupillen en gebrek aan zweten – wezen ook op problemen met het AZS. Haar sensorische en motorische zenuwen – die naast de AZS-zenuwen lopen – waren echter normaal.
Wat was er gebeurd? Auto-immune autonome ganglionopathie (AAG) is een zeldzame ziekte, maar onderzoekers hebben uiteindelijk ontdekt wat er aan de hand is. Het AZS produceert twee soorten ”ganglia” [zenuwknopen] – gebieden waar de zenuwen samenkomen. De parasympathische ganglia bevinden zich in de buurt van de organen, terwijl de sympathische ganglia zich dichtbij het ruggenmerg bevinden. Acetylcholine wordt gebruikt om een kanaal te openen tussen het ene neuron en het andere – en het activeert de zenuwen.
Studies hebben de aanwezigheid van antilichamen bij AAG-patiënten ontdekt die de anti-nicotinische acetylcholine receptoren (nAChR) aanvallen die verantwoordelijk zijn voor het openen van het kanaal tussen twee autonome zenuwen. Als het kanaal geblokkeerd is, kan het signaal niet passeren en kan het AZS niet werken. Dat is waarom haar bloeddruk ernstig daalde als ze rechtstond. Dat is waarom ze zoveel darmproblemen had.
Ze had iets dat wordt gekarakteriseerd als acute pandysautonomie, d.w.z. een plotseling falen van het autonoom zenuwstelsel. Het is sinds 1969 bekend dat dit uitgelokt kan worden door het Epstein-Barrvirus (EBV) – hetzelfde virus dat verantwoordelijk is voor het uitlokken van ME/cvs bij veel mensen. Sommige mensen die dit hebben, ervaren een gedeeltelijk spontaan (d.w.z. onbehandeld) herstel, maar volledig herstel is zeldzaam. Een eenvoudige verkoudheid had het leven van deze persoon voorgoed veranderd.
Bij AAG falen beide kanten van het AZS. Het sympathisch zenuwstelsel schiet tekort tijdens het staan, wat resulteert in een lage bloeddruk (orthostatische hypotensie) en problemen met darmmotiliteit. Parasympathisch falen aan de andere kant leidt tot droge ogen en mond, blaasproblemen, seksuele stoornissen, lage hartslagvariabiliteit en verwijde pupillen die niet reageren op licht.
Mensen met AAG ervaren “autonoom falen”, wat zeldzaam is. Bij autonoom falen werken de zenuwen gewoon niet meer. Bij dysautonomie, wat veel vaker voorkomt, werken de autonome reflexen wel, maar is de balans tussen het SZS en het PZS verstoord. Sommigen mensen hebben een combinatie van beide.
Zoals zo vaak het geval is bij auto-immuniteit, was er was er veel tijd nodig had om alle onduidelijkheid op te klaren. AAG werd oorspronkelijk gediagnosticeerd wanneer de AChR-antilichaamniveaus 0.05 waren, maar de diagnostische criteria zijn nu strikter, en de drempelwaarde voor de ziekte ligt vier keer hoger (van 0.2 tot 5). Bij minder dan 0.2 heeft 50% van degenen met antistoffen helemaal geen autonome symptomen.

Dit onthult een ander lastig aspect van antistoffen en auto-immuunziekten: schadelijke antistoffen kunnen aanwezig zijn zonder veel problemen te veroorzaken; d.w.z. het is vaak het niveau van de antistoffen dat telt. Onderzoekers weten dat AChR-antistoffen “klinisch significant” zijn wanneer ze groter of gelijk aan 0.2 zijn, en over het algemeen veroorzaken ze geen problemen bij lagere niveaus.
Ze hebben ook geleerd dat er verschillende gradaties van AAG bestaan. Mensen met zeer hoge antilichaamniveaus in een vroeg stadium worden doorgaans erg ziek en ervaren een ernstig autonoom falen. Mensen die zich in een vroeg stadium presenteren met lagere antilichaamniveaus, hebben meestal een beperkt autonoom falen. Zoals bij ME/cvs maakt de heftigheid van de vroege immuunrespons blijkbaar een groot verschil. De schade wordt met andere woorden vroeg aangericht.
Net als bij ME/cvs en POTS zijn de meeste mensen met AAG vrouwen. Net als bij deze ziekten melden velen (50%) een viraal begin, maar een gradueel begin komt ook voor. De ziekte wordt ook in verband gebracht met gewrichtshypermobiliteit, MCAS en andere auto-immuunziekten, en over het algemeen met hogere niveaus van antistoffen.
Behandelingen omvatten vaak immunosuppressie (IVIG, plasma-uitwisseling, Rituximab, steroïden) en kunnen erg doeltreffend zijn in sommige gevallen, maar kunnen ook bijwerkingen hebben. Symptomen verbeteren als de antilichaamniveaus dalen. Andere behandelingen omvatten standaardbehandelingen voor orthostatische intolerantie (droxidopa, pyridostigmine, midodrine.)
Wat zeker nog een andere potentiële les is voor heterogene ziekten zoals ME/cvs en POTS hebben, is dat sommigen met acuut autonoom falen geen antilichamen hebben. In plaats daarvan hebben ze een inflammatoire neuropathie: de receptoren voor hun autonome zenuwen worden vernietigd door inflammatie. Dezelfde uitkomst – verschillend reactiepad.
Auto-immuniteit bij POTS en ME/cvs
Bij AAG voorkomen auto-immune of inflammatoire processen dat de receptoren van het autonoom zenuwstelsel boodschappen doorgeven van de zenuwen van het autonoom zenuwstelsel. Dat resulteert in autonoom ‘falen’ – iets dat over het algemeen niet gezien wordt bij ME/cvs of POTS. In plaats daarvan presenteren deze ziekten zich over het algemeen als dysautonomie – een falen om het AZS goed te reguleren.
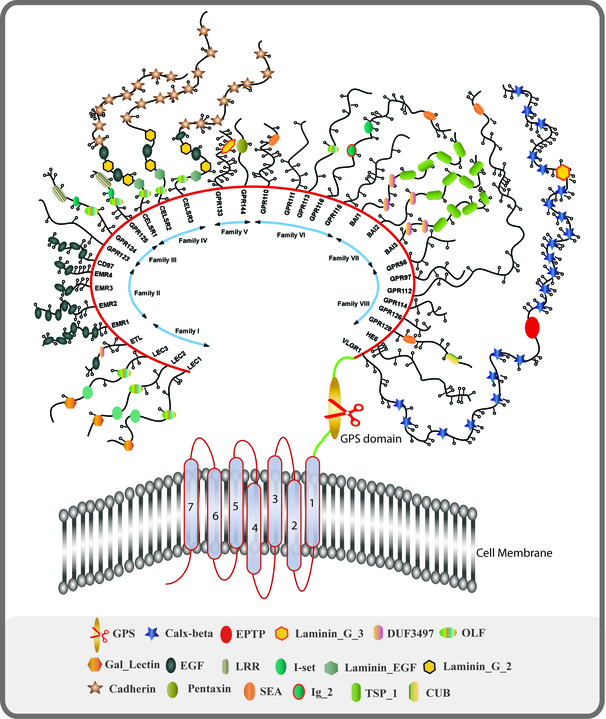
© Martstacey, CC BY-SA 3.0, via Wikimedia Commons
Toch worden sommige van de symptomen en tekenen die gezien worden bij AAG (problemen met staan, darmproblemen, dunnevezelneuropathie, lage hartslagvariabiliteit) ook gevonden bij ME/cvs en POTS. Bovendien zijn, net als bij AAG de meeste patiënten vrouwen, worden de ziekten vaak uitgelokt door een infectie en gaan ze gepaard met andere aandoeningen zoals Ehlers-Danlossyndroom (EDS) en mestcelactivatiesyndroom (MCAS).
Gezien de aanwezige gelijkenissen, rijst de vraag of een auto-immuun of inflammatoir proces ook het autonoom zenuwstels van ME/cvs- en POTS-patiënten treft?
Het grote doelwit op dit moment is de GPCR-familie van receptoren. Deze grote familie bevat verschillende receptoren die in verband staan met stoornissen van het autonoom zenuwstelsel zoals AAG, het syndroom van Sjögren, POTS en mogelijk ME/cvs.
ME/cvs
Er is nog veel niet geweten over ME/cvs. Er moet worden opgemerkt dat van de autoantistoffen die er mogelijk een rol in spelen, wordt verondersteld dat ze natuurlijke regulatoren zijn van autonome functie. Ze worden pathologisch wanneer ze te veel voorkomen en het AZS ofwel overactiveren, ofwel afremmen.
Verhoogde M3- en M4-muscarine en β2-adrenerge autoantistoffen die geassocieerd werden met immuunafwijkingen zijn gevonden bij ME/cvs. Een recente studie suggereerde dat β1- en β2-adrenerge antistoffen geassocieerd waren met structurele veranderingen in de hersenen.
Een andere studie vond verhoogde niveaus van autoantistoffen in het plasma, maar niet in het cerebrospinaal vocht. Er werd echter geen verband gevonden tussen deze antistoffen en toegenomen symptomen – een essentiële vereiste voor een auto-immuunziekte. Whelan maakte het mysterie nog groter toen hij onlangs op de IACFS/ME-conferentie meldde dat hij niet vond dat de antilichamen die in verband werden gebracht met POTS, verhoogd waren bij ME/cvs-patiënten met POTS. Hij vond wel een verband tussen autoantistoffenniveaus en de aanwezigheid van dunnevezelneuropathie (DVN).
Kleine studies suggereren dat immunoadsorptie het niveau van deze antistoffen kunnen verlagen en symptomen verminderen. Rituximab heeft ons echter geleerd om op onze hoede te zijn voor alle bevindingen die niet uit grotere placebogecontroleerde studies komen. Het is niet gemakkelijk om auto-immuniteit in een ziekte te valideren en de zoektocht voor een auto-immune oorzaak van de problemen met het AZS bij ME/cvs staat nog in zijn kinderschoenen.
Maar onlangs opperde een groep onderzoekers, waaronder Carmen Scheibenbogen en Manual Martinez-Lavin, dat ME/cvs, POTS en complex regionaal pijnsyndroom (CRPS) tot een nieuwe categorie van ziekten behoren die ze “auto-immune neurosensorische dysautonomieën” noemen, gedefinieerd door problemen met de GPCR’s.
Wirth en Scheibenbogen hebben ook voorgesteld dat deze autoantistoffen de bloedvaten vernauwen (vasoconstrictie), waardoor de bloedstroom en het zuurstofverbruik verminderen. Ze denken dat de problemen kunnen leiden tot een toename van vaatverwijders zoals bradykinine, die pijn, vermoeidheid en andere symptomen veroorzaken.
Posturaal Orthostatisch tachycardiesyndroom (POTS)
Er is veel meer bewijs van GPCR-problemen bij POTS, maar de studies zijn over het algemeen klein. Toch hebben verschillende studies verhoogde niveaus van antistoffen gevonden tegen alfa- en bèta-adrenerge en/of muscarine receptoren. Vorig jaar vond een studie verhoogde autoantistoffen tegen de alfa-1-adrenerge receptor (89%) en de muscarine acetylcholine M4-receptor (53%). Zoals met AAG werd een blootstelling aan EBV vastgesteld. Activatie van het sympathisch zenuwstelsel, problemen met de bloeddoorstroming en verminderd bloedvolume zouden allemaal verklaard kunnen worden door problemen met GPCR’s.
Ook vorig jaar heeft de hypothese van auto-immuniteit bij POTS een stap voorwaarts gezet met de productie van een diermodel. De studie was klein, maar suggereerde niettemin dat een auto-immuunrespons tegen alfa-1- en bèta-1-adrenerge receptoren waarschijnlijk voor de hoge hartslag en verminderde bloeddruk zou zorgen die bij POTS gezien wordt. Hoewel ze erkenden dat er nog veel werk moest worden verricht, verklaarden twee onderzoekers dat de productie van het diermodel “van cruciaal belang was voor toekomstig POTS-onderzoek.”
Een volgende stap voorwaarts werd gezet met de publicatie van een paper die aantoont dat het serum (bloed) van POTS-patiënten een ongewone activering van de receptoren in kwestie teweegbracht. Die activatie werd op haar beurt in verband gebracht met problemen bij het staan en stappen. Voor POTS zijn nog steeds grotere studies nodig, en vergelijkingen met verschillende ziektegroepen, maar POTS komt steeds dichterbij.
Conclusie
AAG is een zeldzame ziekte waarbij autoantilichamen zich richten tegen receptoren van het autonoom zenuwstelsel en autonoom falen veroorzaken – en nogal wat symptomen die overlappen met ME/cvs en POTS. Het duurde enige tijd om te begrijpen welke niveaus van autoantistoffen klinische betekenis hadden. Na verloop van tijd werd het ook duidelijk dat sommige gevallen van AAG inflammatoir in oorsprong zijn en niet auto-immuun.
ME/cvs en POTS zijn verschillend en gelijkaardig. Beide ziekten vertonen problemen met het autonoom zenuwstelsel, en hebben enig verband met gewrichtshypermobiliteit en mestcelactivatiesyndroom. De dysautononomieproblemen bij ME/cvs en POTS lijken het resultaat te zijn van autonome regulatie, niet autonoom falen. Als er sprake is van een auto-immuunproces, dan veroorzaakt dat waarschijnlijk een toename van natuurlijk voorkomende antilichamen die het autonoom zenuwstelsel ontregelen.
Meer en meer onderzoek suggereert dat een subgroep van POTS auto-immuun van oorsprong is. Er is een diermodel gemaakt en POTS-onderzoekers zijn verder gegaan dan het meten van antilichaamniveaus en hebben nu ook het effect van bloed van POTS-patiënten op receptorresponsiviteit beoordeeld. Er zijn echter grotere studies nodig om de bevinding te valideren en mogelijk de deur open te zetten naar de mogelijkheid om auto-immuungeneesmiddelen te gebruiken voor POTS.
De jacht op een auto-immuune oorzaak van de autonome problemen bij ME/cvs is aan de gang. Interessant is dat een van dezelfde autoantistoffen die bij POTS worden gevonden, ook bij ME/cvs lijkt te worden gevonden. Hoewel sommige resultaten veelbelovend zijn, zijn andere raadselachtig. We beginnen nog maar pas te begrijpen wat de rol is die auto-immuniteit kan spelen bij de problemen met het autonoom zenuwstelsel bij ME/cvs.
© Health Rising, 29 oktober 2020. Vertaling Zuiderzon, redactie Abby, ME-gids.





