Dit artikel uit Frontiers in Immunology bevat veel nuttige informatie die handig is voor ME/CVS-patiënten. Omdat het een extreem groot en diepgaand artikel is, waarbij 593 referentie onderzoeken zijn gebruikt, hebben we er een reeks van gemaakt met steeds een vertaald en samengevat deel.
𝗠𝘆𝗮𝗹𝗴𝗶𝗰 𝗘𝗻𝗰𝗲𝗽𝗵𝗮𝗹𝗼𝗺𝘆𝗲𝗹𝗶𝘁𝗶𝘀/𝗖𝗵𝗿𝗼𝗻𝗶𝗰 𝗙𝗮𝘁𝗶𝗴𝘂𝗲 𝗦𝘆𝗻𝗱𝗿𝗼𝗺𝗲: 𝘁𝗵𝗲 𝗯𝗶𝗼𝗹𝗼𝗴𝘆 𝗼𝗳 𝗮 𝗻𝗲𝗴𝗹𝗲𝗰𝘁𝗲𝗱 𝗱𝗶𝘀𝗲𝗮𝘀𝗲
Auteurs: Hayley E. Arron, Benjamin D. Marsh, Douglas B. Kell, M. Asad Khan, Beate R. Jaeger en Etheresia Pretorius
Publicatiedatum: 3 juni 2024
Gepubliceerd in: Frontiers in Immunology
Link naar het originele artikel:
Vertaling door Millions Missing Holland:
𝗦𝗮𝗺𝗲𝗻𝘃𝗮𝘁𝘁𝗶𝗻𝗴 𝗮𝗿𝘁𝗶𝗸𝗲𝗹:
Myalgische Encefalomyelitis/Chronisch Vermoeidheidssyndroom (ME/CVS) is een chronische, invaliderende ziekte die gekenmerkt wordt door een breed scala aan symptomen die alle aspecten van het leven ernstig beïnvloeden. Ondanks de aanzienlijke prevalentie blijft ME/CVS een van de meest onderbestudeerde en onbegrepen aandoeningen in de moderne geneeskunde. Er ontbreken gestandaardiseerde diagnostische criteria en er zijn momenteel geen effectieve behandelingen beschikbaar.
𝗦𝘆𝗺𝗽𝘁𝗼𝗺𝗲𝗻 𝗲𝗻 𝗲𝗿𝗻𝘀𝘁
ME/CVS patiënten vertonen uiteenlopende symptomen die meerdere lichaamssystemen beïnvloeden. Een kenmerkend symptoom is post-exertionele malaise (PEM), waarbij de symptomen verslechteren na minimale fysieke, cognitieve of emotionele inspanning. Andere veelvoorkomende symptomen zijn aanhoudende vermoeidheid, cognitieve stoornissen, slaapstoornissen, en pijn.
De ernst van ME/CVS varieert van mild tot zeer ernstig:
- Mild: In staat om lichte taken uit te voeren, maar met moeite.
- Matig: Verminderde mobiliteit, vaak niet in staat om te werken of naar school te gaan.
- Ernstig: Meestal aan huis gebonden, met een functionele capaciteit van 5-15%.
- Zeer ernstig: Bedlegerig, met een functionele capaciteit van minder dan 5%.
𝗗𝗶𝗮𝗴𝗻𝗼𝘀𝘁𝗶𝘀𝗰𝗵𝗲 𝗰𝗿𝗶𝘁𝗲𝗿𝗶𝗮
Er bestaan verschillende diagnostische criteria voor ME/CVS, maar geen enkele is universeel geaccepteerd. Diagnostiek is vaak gebaseerd op medische geschiedenis, lichamelijk onderzoek en uitsluiting van andere aandoeningen. Dit proces kan jaren duren, wat leidt tot vertraging in diagnose en behandeling.
𝗣𝗮𝘁𝗵𝗼𝗳𝘆𝘀𝗶𝗼𝗹𝗼𝗴𝗶𝗲 𝗲𝗻 𝗼𝗼𝗿𝘇𝗮𝗸𝗲𝗻
ME/CVS heeft waarschijnlijk een multifactoriële oorsprong, waarbij genetische kwetsbaarheden en omgevingsfactoren, zoals virale infecties, een rol spelen. De ziekte wordt gekenmerkt door immuundysregulatie, chronische ontsteking, darmdysbiose en stofwisselingsstoornissen. Deze complexe interactie van factoren onderstreept de noodzaak van een holistische benadering voor de diagnose en behandeling van ME/CVS.
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲 𝗲𝗻 𝘁𝗼𝗲𝗸𝗼𝗺𝘀𝘁𝗶𝗴 𝗼𝗻𝗱𝗲𝗿𝘇𝗼𝗲𝗸
Het artikel pleit voor een geïntegreerd model van ME/CVS dat de multifactoriële oorsprong van de ziekte erkent. Dit model biedt nieuwe mogelijkheden voor onderzoek en potentiële therapeutische strategieën. De wetenschappelijke gemeenschap wordt aangespoord om de complexiteit van ME/CVS te heroverwegen en een veelzijdige aanpak te hanteren voor de studie en het beheer van deze aandoening.
𝗪𝗮𝘁 𝗶𝘀 𝗠𝗘/𝗖𝗩𝗦?

Myalgische Encefalomyelitis/Chronisch Vermoeidheidssyndroom (ME/CVS), ook bekend als Systemic Exertion Intolerance Disease (SEID), is een slopende chronische multisysteemziekte. Het beïnvloedt vele aspecten van het leven van de patiënt en wordt gekenmerkt door een breed scala aan symptomen. Ondanks de aanzienlijke prevalentie blijft ME/CVS een van de meest onderbelichte en onbegrepen aandoeningen in de moderne geneeskunde.
𝗣𝗿𝗲𝘃𝗮𝗹𝗲𝗻𝘁𝗶𝗲 𝗲𝗻 𝗶𝗺𝗽𝗮𝗰𝘁
ME/CVS treft naar schatting 17 tot 24 miljoen mensen wereldwijd, met een prevalentie variërend van 0,1-0,8%. In de VS zijn er ongeveer 836.000 tot 2,5 miljoen mensen met ME/CVS, waarvan een kwart huis- of bedgebonden is. In Engeland en Wales lijden meer dan 250.000 mensen aan deze ziekte. Het treft alle leeftijden, rassen en sociaal-economische groepen, maar vrouwen worden 2-3 keer vaker getroffen dan mannen. De economische impact is enorm, met geschatte kosten van $18-24 miljard per jaar in de VS en £3,3 miljard per jaar in Groot-Brittannië, grotendeels vanwege werkloosheid onder patiënten.
𝗗𝗶𝗮𝗴𝗻𝗼𝘀𝘁𝗶𝘀𝗰𝗵𝗲 𝘂𝗶𝘁𝗱𝗮𝗴𝗶𝗻𝗴𝗲𝗻
Een van de grootste uitdagingen bij ME/CVS is het gebrek aan gestandaardiseerde diagnostische criteria. Verschillende richtlijnen hanteren uiteenlopende inclusie- en exclusiecriteria, wat de diagnose bemoeilijkt. Hierdoor zijn er momenteel geen effectieve (genezende) behandelingen beschikbaar.
𝗢𝗼𝗿𝘇𝗮𝗸𝗲𝗻 𝗲𝗻 𝗽𝗮𝘁𝗵𝗼𝗳𝘆𝘀𝗶𝗼𝗹𝗼𝗴𝗶𝗲
ME/CVS wordt beschouwd als een gevolg van een complex samenspel van genetische kwetsbaarheden en omgevingsfactoren, zoals virale infecties. Dit leidt tot een reeks pathologische reacties, waaronder ontregeling van het immuunsysteem, chronische ontstekingen, darmdysbiose en metabolische stoornissen. Ons begrip van deze ziekte wordt vergroot door een holistische benadering, die deze verschillende elementen integreert in een samenhangend model.
𝗢𝗻𝗱𝗲𝗿𝘇𝗼𝗲𝗸𝘀𝗽𝗿𝗶𝗼𝗿𝗶𝘁𝗲𝗶𝘁𝗲𝗻
Het is essentieel om de complexe pathofysiologie van ME/CVS verder te onderzoeken en te begrijpen. Dit zal nieuwe wegen openen voor onderzoek en potentiële therapeutische strategieën. Er is een dringende behoefte aan een multifactoriële benadering voor de diagnose, studie en behandeling van ME/CVS, waarbij de wetenschappelijke gemeenschap wordt aangespoord om de complexiteit van de ziekte te erkennen en een veelzijdige aanpak te hanteren.
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲
ME/CVS is een ernstige, invaliderende ziekte met een aanzienlijke impact op het leven van de patiënten en de economie. Een beter begrip van de oorzaken en pathofysiologie is cruciaal voor het ontwikkelen van effectieve behandelingen. Het is tijd voor een paradigmaverschuiving in hoe we deze complexe ziekte benaderen en behandelen, met een holistische benadering die recht doet aan de veelzijdigheid van ME/CVS.
𝗠𝗘/𝗖𝗩𝗦-𝘀𝘆𝗺𝗽𝘁𝗼𝗺𝗲𝗻

Myalgische Encefalomyelitis/Chronisch Vermoeidheidssyndroom (ME/CVS) is een complexe en heterogene ziekte, wat betekent dat patiënten uiteenlopende symptomen vertonen die verschillende lichaamssystemen beïnvloeden.
Een uniek kenmerk dat ME/CVS onderscheidt van andere ziekten is de verergering van symptomen na zelfs minimale fysieke, cognitieve, orthostatische of emotionele inspanning. Dit fenomeen staat bekend als post-exertionele malaise (PEM) of post-exertionele symptoomexacerbatie (PESE).
𝗞𝗲𝗻𝗺𝗲𝗿𝗸𝗲𝗻 𝘃𝗮𝗻 𝗣𝗘𝗠
Na inspanning ervaren patiënten een verminderd mentaal en fysiek uithoudingsvermogen, samen met versnelde spier- en cognitieve vermoeidheid. PEM wordt gekenmerkt door:
- Vertraagd begin: symptomen verschijnen meestal uren of zelfs dagen na de inspanning.
- Lange duur: de symptomen houden veel langer aan dan de aanvankelijke inspanning zou doen vermoeden.
- Intensiteit: de ernst van de symptomen staat niet in verhouding tot de geringe mate van inspanning.
Uitputting is een opvallend kenmerk bij de meeste patiënten met ME/CVS. In tegenstelling tot normale vermoeidheid wordt deze niet verlicht door slaap of rust. De uitputting is continu en ernstig, wat een enorme impact heeft op het dagelijks functioneren van de patiënten.
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲
ME/CVS is een invaliderende ziekte met een breed scala aan symptomen en een uniek kenmerk, post-exertionele malaise (PEM), die het onderscheidt van andere aandoeningen. Het begrijpen en herkennen van deze symptomen is cruciaal voor het bieden van de juiste zorg en ondersteuning aan de getroffen patiënten.
𝗣𝗿𝗼𝗴𝗻𝗼𝘀𝗲 𝗲𝗻 𝗯𝗲𝗵𝗮𝗻𝗱𝗲𝗹𝗶𝗻𝗴
De vooruitzichten op de lange termijn voor patiënten met ME/CVS variëren aanzienlijk. Een cruciale factor om een prognose te geven is hoe de ziekte in de beginfase wordt behandeld. De kans op volledig herstel is echter laag, geschat op slechts 5%. De meeste patiënten herwinnen niet hun volledige functie van vóór ME/CVS, en ongeveer een derde van de patiënten verslechtert zodanig dat ze huis- of bedgebonden raken.
𝗜𝗺𝗽𝗮𝗰𝘁 𝗼𝗽 𝗹𝗲𝘃𝗲𝗻𝘀𝗸𝘄𝗮𝗹𝗶𝘁𝗲𝗶𝘁
ME/CVS vermindert de levenskwaliteit van patiënten aanzienlijk. Dit heeft gevolgen voor dagelijkse activiteiten, sociale contacten, het gezinsleven, emotioneel welzijn, werk en onderwijs. Onderzoeken tonen aan dat de levenskwaliteit van ME/CVS-patiënten lager is dan die van mensen met andere chronische ziekten, zoals multiple sclerose (MS), longziekte, reumatoïde artritis (RA), en sommige vormen van kanker. Net als bij andere invaliderende chronische ziekten komen depressie en angst vaak voor bij ME/CVS, en is er een verhoogd risico op zelfmoord.
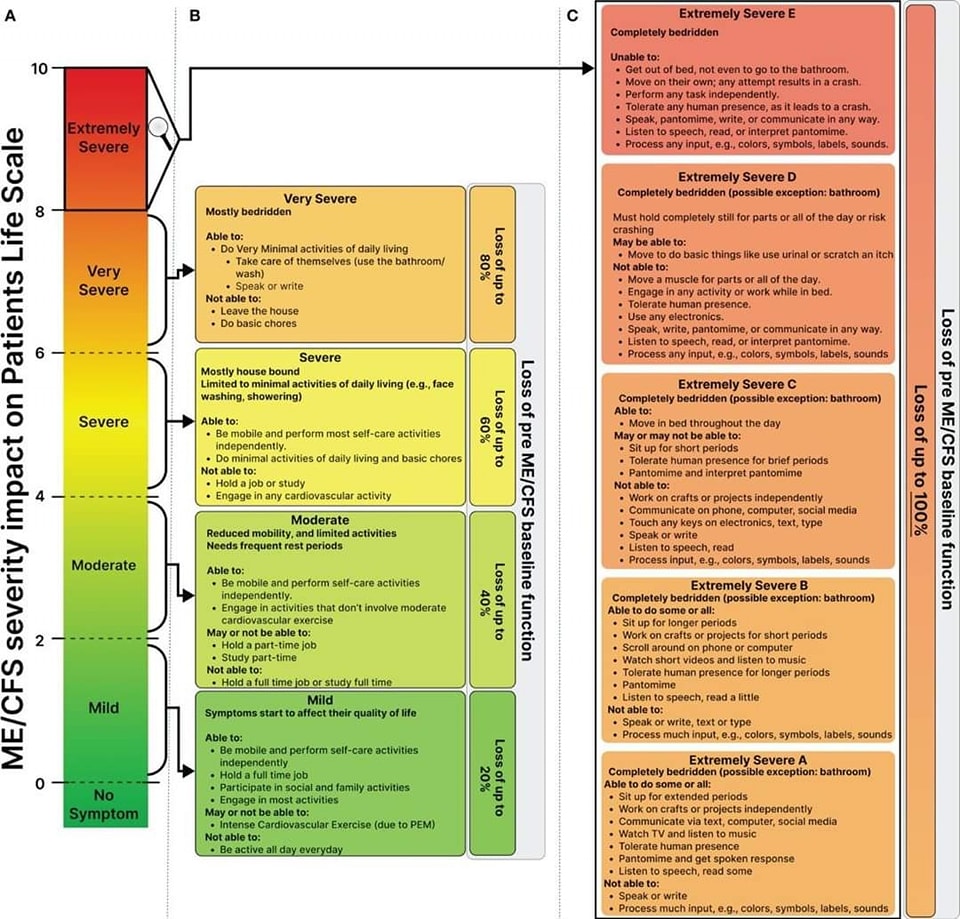
𝗜𝗻𝗱𝗲𝗹𝗶𝗻𝗴 𝗻𝗮𝗮𝗿 𝗲𝗿𝗻𝘀𝘁 𝘃𝗮𝗻 𝘀𝘆𝗺𝗽𝘁𝗼𝗺𝗲𝗻
De symptomen van ME/CVS kunnen worden onderverdeeld in vier niveaus van ernst:
1. Mild: Individuen kunnen nog werken of studeren en lichte taken uitvoeren, maar ondervinden mobiliteitsproblemen en beperkingen in hun sociale leven.
2. Matig: Beperkte mobiliteit, onvermogen om te werken of studeren, verminderde slaapkwaliteit en de noodzaak om regelmatig te rusten.
3. Ernstig: Patiënten zijn huisgebonden, hebben een functionele capaciteit van 5% tot 15%, ervaren cognitieve problemen en zijn overgevoelig voor externe prikkels.
4. Zeer ernstig: Patiënten zijn bedlegerig, hebben een functionele capaciteit van minder dan 5%, zijn volledig afhankelijk van anderen voor zorg, hebben sondevoeding nodig, kunnen zichzelf niet verzorgen en zijn zeer gevoelig voor zintuiglijke prikkels.
𝗟𝗲𝘃𝗲𝗻 𝗺𝗲𝘁 𝗳𝗹𝘂𝗰𝘁𝘂𝗲𝗿𝗲𝗻𝗱𝗲 𝘀𝘆𝗺𝗽𝘁𝗼𝗺𝗲𝗻
ME/CVS is een aandoening die fluctueert en waarbij symptomen van aard en ernst veranderen. Ongeveer 61% van de patiënten meldt dat ze op hun slechtste dagen bedgebonden zijn en minstens een kwart heeft op een bepaald moment in hun leven huis- of bedgebondenheid ervaren. Patiënten moeten zich voortdurend aanpassen aan opflakkeringen en terugvallen.
𝗢𝗻𝗱𝗲𝗿𝘇𝗼𝗲𝗸 𝗼𝗻𝗱𝗲𝗿 𝗠𝗘/𝗖𝗩𝗦-𝗣𝗮𝘁𝗶𝗲̈𝗻𝘁𝗲𝗻
Uit een onderzoek onder 1418 ME/CVS-patiënten bleek dat:
- 98,5% moeite had met het uitvoeren van dagelijkse taken, en meer dan de helft was totaal niet in staat hun gebruikelijke activiteiten uit te voeren.
- 93,9% ervoer matige tot extreme pijn.
- 88,6% had moeite met mobiliteit.
- 67,3% had problemen met zichzelf wassen of aankleden.
𝗜𝗺𝗽𝗮𝗰𝘁 𝗼𝗽 𝗳𝗮𝗺𝗶𝗹𝗶𝗲 𝗲𝗻 𝘃𝗲𝗿𝘇𝗼𝗿𝗴𝗲𝗿𝘀
ME/CVS treft ook de familieleden en verzorgers van patiënten ernstig. Uit het onderzoek bleek dat:
- 96,1% van de verzorgers zich zorgen maakte over hun familielid.
- 84,7% vond het moeilijk om voor hun familielid te zorgen.
- 91,8% meldde dat gezinsactiviteiten werden beïnvloed.
De zorg voor een familielid met ME/CVS heeft ook een negatieve invloed op slaap, werk, vakanties, financiën en het seksleven van de verzorgers.
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲
ME/CVS heeft een aanzienlijke impact op zowel de patiënten als hun families, met lage kansen op volledig herstel en grote uitdagingen in het dagelijks leven. Het is belangrijk dat deze ziekte serieus wordt genomen en dat er meer onderzoek en steun komt voor zowel patiënten als hun verzorgers.
𝗗𝗶𝗮𝗴𝗻𝗼𝘀𝘁𝗶𝘀𝗰𝗵𝗲 𝗰𝗿𝗶𝘁𝗲𝗿𝗶𝗮 𝘃𝗼𝗼𝗿 𝗠𝗘/𝗖𝗩𝗦

𝗡𝗲𝘂𝗿𝗼𝗹𝗼𝗴𝗶𝘀𝗰𝗵𝗲 𝗰𝗹𝗮𝘀𝘀𝗶𝗳𝗶𝗰𝗮𝘁𝗶𝗲 𝗲𝗻 𝗯𝗲𝘃𝗶𝗻𝗱𝗶𝗻𝗴𝗲𝗻
In 1969 classificeerde de Wereldgezondheidsorganisatie (WHO) de aandoening Myalgische Encefalomyelitis/Chronisch Vermoeidheidssyndroom (ME/CVS) als een neurologische ziekte. Deze classificatie was gebaseerd op de neurologische kenmerken van de aandoening.
Recent onderzoek met positronemissietomografie (PET) toont aan dat ME/CVS-patiënten neuro-inflammatie in de hersenen vertonen. Daarnaast zijn er afwijkingen in de witte en grijze stof waargenomen. Deze neuro-inflammatie kan samenhangen met cognitieve stoornissen, zoals:
- Langzamere informatieverwerking
- Verminderde reactietijd
- Tragere werking van het werkgeheugen
- Verminderde aandacht
𝗗𝗶𝗮𝗴𝗻𝗼𝘀𝘁𝗶𝘀𝗰𝗵𝗲 𝗰𝗿𝗶𝘁𝗲𝗿𝗶𝗮 𝗲𝗻 𝘂𝗶𝘁𝗱𝗮𝗴𝗶𝗻𝗴𝗲𝗻
Ondanks de hoge prevalentie van ME/CVS zijn er nog geen universeel geaccepteerde diagnostische criteria, wat een vroege en nauwkeurige diagnose bemoeilijkt. Er bestaan verschillende diagnostische criteria, zoals geïllustreerd in figuur 3 van het besproken artikel, maar er is geen consensus over welke het meest bruikbaar en gevalideerd is.
𝗭𝗲𝗹𝗳𝘀𝗰𝗼𝗿𝗲𝗻𝗱𝗲 𝗕𝗲𝗹𝗹-𝗵𝗮𝗻𝗱𝗶𝗰𝗮𝗽𝘀𝗰𝗵𝗮𝗮𝗹
Veel volwassen ME/CVS-patiënten gebruiken de zelfscorende Bell-handicapschaal voor chronische vermoeidheid en immuundisfunctie (CFIDS), ontwikkeld door Dr. David Bell in 1995. Deze schaal is echter subjectief en de scores kunnen fluctueren door de wisselende aard van de ziekte en afhankelijk van de arts die de score uitvoert. Dit maakt het moeilijk voor artsen om een eenduidige diagnose te stellen.
𝗕𝗲𝗹𝗮𝗻𝗴 𝘃𝗮𝗻 𝗣𝗼𝘀𝘁-𝗘𝘅𝗲𝗿𝘁𝗶𝗼𝗻𝗲𝗹𝗲 𝗠𝗮𝗹𝗮𝗶𝘀𝗲 (𝗣𝗘𝗠)
PEM, de verergering van symptomen na inspanning, is een belangrijk diagnostisch kenmerk van ME/CVS. De ernst van PEM kan variëren van minimaal tot extreem ernstig, waarbij zelfs basisactiviteiten zoals spreken, denken, eten en drinken, en orthostatische tolerantie worden beïnvloed. Het ontstaat ook bij ernstige en zeer ernstige patiënten die niet in staat zijn tot zelfs de geringste inspanning.
𝗗𝗶𝗮𝗴𝗻𝗼𝘀𝘁𝗶𝘀𝗰𝗵 𝗽𝗿𝗼𝗰𝗲𝘀
De huidige diagnostiek van ME/CVS is gebaseerd op:
- Medische geschiedenis
- Lichamelijk onderzoek
- Klinische observaties
Dit proces vergt vaak meerdere doktersbezoeken en kan vermoeiend zijn voor de patiënt. Bovendien leunt de diagnose zwaar op de uitsluiting van andere stoornissen, aangezien de symptomen van ME/CVS overlappen met die van veel andere medische aandoeningen. Hierdoor kan het jaren duren voordat individuen een definitieve diagnose krijgen, vooral door de verschillen in uitsluitingscriteria binnen verschillende definities van ME/CVS, zoals benadrukt door Jason et al., 2012.
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲
De diagnose en behandeling van ME/CVS blijven uitdagend vanwege de complexiteit en de overlapping van symptomen met andere aandoeningen. Het is essentieel om de diagnostische criteria voortdurend te herevalueren en te verbeteren om de zorg en het begrip van deze invaliderende ziekte te optimaliseren.
𝗗𝗲 𝗿𝗼𝗹 𝘃𝗮𝗻 𝗴𝗲𝗻𝗲𝘁𝗶𝘀𝗰𝗵𝗲 𝗮𝗮𝗻𝗹𝗲𝗴 𝗲𝗻 𝘃𝗶𝗿𝗮𝗹𝗲 𝘁𝗿𝗶𝗴𝗴𝗲𝗿𝘀
𝗠𝘂𝗹𝘁𝗶𝗳𝗮𝗰𝘁𝗼𝗿𝗶𝗲̈𝗹𝗲 𝗼𝗼𝗿𝘀𝗽𝗿𝗼𝗻𝗴
ME/CVS wordt gekenmerkt door diverse symptomen en een heterogene patiëntengroep, wat wijst op een multifactoriële oorsprong waarbij meerdere fysiologische processen betrokken zijn. Het is onwaarschijnlijk dat één enkel eiwit- of RNA-transcript consistent zal zijn over het gehele ziektespectrum. Stressvolle of traumatische incidenten bij genetisch gevoelige individuen kunnen de ontwikkeling van ME/CVS-symptomen uitlokken. Deze stressoren kunnen variëren van acute infecties en emotionele stress tot dagelijkse activiteiten zoals een korte wandeling of temperatuurverandering. Deze interactie leidt tot een toestand van ‘afwijkende homeostase’, waarin het lichaam functioneert op een minder optimaal niveau.
𝗚𝗲𝗻𝗲𝘁𝗶𝘀𝗰𝗵𝗲 𝗮𝗮𝗻𝗹𝗲𝗴
Er is nog weinig consensus over de genetische, cellulaire en moleculaire invloeden die het risico op ME/CVS veranderen. Er wordt gedacht dat ME/CVS mogelijk een genetische aanleg heeft, aangezien het vaak voorkomt bij meerdere leden van dezelfde familie. Tweelingstudies en genealogische analyses hebben een genetische link aangetoond tussen ME/CVS-patiënten en hun nakomelingen, wat suggereert dat er meerdere genen en allelen zijn die het risico vergroten.
Genen zijn stukjes DNA die specifieke eigenschappen of functies in het lichaam regelen, terwijl allelen varianten van die genen zijn. Zo kan een gen bijvoorbeeld de haarkleur bepalen, en de verschillende allelen van dat gen zorgen voor variaties, zoals blond, bruin of rood haar. In het geval van ME/CVS zouden bepaalde allelen van verschillende genen het risico op de ziekte kunnen verhogen.
Verschillende studies hebben polymorfismen gevonden in genen die het immuunsysteem beïnvloeden bij ME/CVS-patiënten. Polymorfismen zijn variaties in DNA die van persoon tot persoon kunnen verschillen. Zo is bij ME/CVS-patiënten een toename te zien van de TNF-857 TT- en CT-genotypen en een afname van IFN-gamma-productie. Andere onderzoeken laten zien dat bepaalde genetische veranderingen invloed hebben op de hormoonbalans, zoals verminderde DNA-methylatie van NR3C1-1F. DNA-methylatie is een proces dat genactiviteit regelt door het ‘uit’ of ‘aan’ te zetten. Dit sluit aan bij de theorie van een verminderde functie van de HPA-as, het stressregulerende systeem. Ook mutaties in metabolische routes – de chemische processen in het lichaam die energie en stoffen omzetten – zoals in het IDO2-gen, lijken betrokken te zijn bij ME/CVS.
Ondanks deze bevindingen blijven de resultaten van genetische onderzoeken wisselend. Grote genoombrede associatiestudies (GWAS), die het hele DNA screenen om risicofactoren te vinden, hebben nog geen herhaalbare DNA-variant aangetoond. Dit betekent dat verder onderzoek nodig is om de genetische risicofactoren beter te begrijpen.
𝗩𝗶𝗿𝗮𝗹𝗲 𝘁𝗿𝗶𝗴𝗴𝗲𝗿𝘀 𝗲𝗻 𝗿𝗲𝗮𝗰𝘁𝗶𝘃𝗲𝗿𝗶𝗻𝗴
Infectie wordt vaak genoemd als een trigger voor ME/CVS, waarbij meer dan 80% van de patiënten aangeeft dat hun symptomen begonnen na een infectieuze episode. Tweederde van de gevallen van ME/CVS ontstaat na een virale infectie, ondersteund door meerdere uitbraken in dezelfde geografische regio.

Veel chronische ziekten, waaronder ME/CVS, worden geassocieerd met de reactivering van latente virussen zoals Epstein-Barr Virus (EBV). Wanneer zo’n virus weer actief wordt tijdens een ziekte, kan dit problemen veroorzaken in het zenuwstelsel en het immuunsysteem verstoren. Bij chronische ziekten zoals ME/CVS kunnen hierdoor klachten ontstaan zoals posturaal orthostatisch tachycardiesyndroom (POTS), extreme vermoeidheid na inspanning (post-exertionele malaise, PEM), algemene vermoeidheid en andere lichamelijke problemen.
Herpesvirussen, waaronder EBV, worden beschouwd als mogelijke oorzaken van ME/CVS. Onderzoekers denken dat het opnieuw actief worden van deze virussen een belangrijke rol speelt in het ontwikkelen van ME/CVS. Bepaalde virale eiwitten, zoals BRRF1 en BLLF3, kunnen schade aan cellen veroorzaken, het immuunsysteem in de war brengen en de energieproductie van de cellen verstoren.
Hoewel eerdere onderzoeken naar de rol van virussen tegenstrijdige resultaten hebben opgeleverd, blijft de theorie dat virussen betrokken zijn bij ME/CVS belangrijk. Verschillen tussen patiënten en hoe de ziekte wordt gedefinieerd, hebben mogelijk bijgedragen aan de wisselende onderzoeksresultaten.
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲
De complexe interactie tussen genetische aanleg en virale triggers speelt een cruciale rol in de ontwikkeling van ME/CVS. Meer onderzoek is nodig om de specifieke genetische en virale factoren beter te begrijpen, wat kan leiden tot verbeterde diagnostische en therapeutische benaderingen voor deze invaliderende ziekte. Het vaststellen van genetische risicofactoren en het begrijpen van virale mechanismen zal helpen om het scepticisme rondom ME/CVS te verminderen en de erkenning van de ziekte te verbeteren.
𝗗𝗲 𝗿𝗼𝗹 𝘃𝗮𝗻 𝘁𝗼𝘅𝗶𝗻𝗲𝘀 𝗲𝗻 𝗺𝗲𝗱𝗶𝗰𝗶𝗷𝗻𝗲𝗻 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦
𝗕𝗹𝗼𝗼𝘁𝘀𝘁𝗲𝗹𝗹𝗶𝗻𝗴 𝗮𝗮𝗻 𝘁𝗼𝘅𝗶𝗻𝗲𝘀
Er wordt verondersteld dat blootstelling aan toxines, zoals organofosfaten en zware metalen, een rol kan spelen bij de ontwikkeling van ME/CVS. Onderzoekers ontdekten in de jaren zestig dat werknemers met chronische blootstelling aan organofosfaten (bijvoorbeeld insecticiden) aanhoudende veranderingen in het centrale zenuwstelsel (CZS) ervaarden. Symptomen omvatten invaliderende vermoeidheid, myalgie, overmatige slaap, nachtelijk zweten, symptomen van prikkelbare darmsyndroom (IBS) en mentale veranderingen. Organofosfaten zouden verschillende afwijkingen veroorzaken, zoals een verhoogde prevalentie van lymfoproliferatieve aandoeningen door een verminderde functie van natuurlijke killercellen (NK) en cytotoxische T-cellen.
Daarnaast kan blootstelling aan zware metalen, zoals cadmium, kan bijdragen aan de ontwikkeling van ME/CVS (Myalgische Encefalomyelitis/Chronisch Vermoeidheidssyndroom). Cadmium is een veelvoorkomende vervuiler in het milieu en op werkplekken. Dit metaal kan schade aan zenuwcellen (neuronen) veroorzaken, wat kan leiden tot hun dood. Deze schade gebeurt via twee processen: apoptose, een natuurlijke vorm van celdood, en necrose, waarbij cellen ongereguleerd afsterven. Hierbij spelen ook schadelijke stoffen zoals reactieve zuurstofsoorten (ROS) en oxidatie van vetten (lipidenperoxidatie) een rol, die extra schade aan de cellen kunnen toebrengen. Dit kan het afgenomen grijzestofvolume en neurologische disfuncties bij ME/CVS verklaren, zoals een verminderd aandachtsniveau en geheugen. Bovendien kan cadmium de cerebrale bloedstroom verminderen en ontstekingsprocessen accentueren, wat de HPA-as (hypothalamus-hypofyse-bijnier-as) kan verstoren en symptomen van ME/CVS kan veroorzaken.
𝗩𝗮𝗰𝗰𝗶𝗻𝗮𝘁𝗶𝗲𝘀 𝗲𝗻 𝗠𝗘/𝗖𝗩𝗦
Er zijn gevallen geregistreerd van ME/CVS na immunisatie (het proces waarbij het immuunsysteem van een persoon wordt versterkt), wat angst heeft gewekt bij patiënten dat vaccinaties hun immuunsysteem zouden kunnen verergeren. Bijvoorbeeld, de ontwikkeling van ME/CVS is geregistreerd na de Spoetnik V-vaccinatie tegen COVID-19. Sommige onderzoeken naar vaccinveiligheid richten zich op hulpstoffen die worden gebruikt om langdurige immunisatie te bevorderen, zoals aluminiumhydroxidezouten. Deze hulpstoffen kunnen abnormaal blijven bestaan in immuuncellen, wat kan resulteren in macrofagische myofasciitis-laesies en geassocieerde spiernecrose ( afsterven van spierweefsel). Ondanks deze bevindingen is er geen verhoogd risico gevonden op het ontwikkelen van ME/CVS na HPV-vaccinatie. Bovendien hebben ME/CVS-patiënten vergelijkbare immuunreacties als gezonde controles na griepvaccinatie, zonder verergering van de symptomen.
𝗠𝗲𝗱𝗶𝗰𝗶𝗷𝗻𝗲𝗻 𝗲𝗻 𝗠𝗘/𝗖𝗩𝗦

Blootstelling aan bepaalde medicijnen kan ook symptomen veroorzaken die typisch zijn voor ME/CVS. Fluorochinolon-antibiotica, vaak voorgeschreven voor infecties zoals longontsteking en sinusitis, zijn geassocieerd met tendinopathie (peesschade), waarbij oxidatieve stress en mitochondriale toxiciteit betrokken zijn. Het gebruik van dergelijke medicijnen kan leiden tot multisysteemeffecten en de ontwikkeling van chronische ziekten zoals ME/CVS.
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲
De mogelijke rol van toxines, vaccinaties en medicijnen bij de ontwikkeling van ME/CVS benadrukt de complexiteit en heterogeniteit van deze ziekte. Meer onderzoek is nodig om de exacte mechanismen en risicofactoren beter te begrijpen. Dit kan bijdragen aan effectievere preventie- en behandelingsstrategieën voor ME/CVS.
𝗔𝗰𝘂𝘁𝗲 𝗼𝗻𝘁𝘀𝘁𝗲𝗸𝗶𝗻𝗴, 𝗶𝗺𝗺𝘂𝘂𝗻𝗮𝗰𝘁𝗶𝘃𝗮𝘁𝗶𝗲 𝗲𝗻 𝗱𝗮𝗿𝗺𝗱𝘆𝘀𝗯𝗶𝗼𝘀𝗲 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦
Bij ME/CVS (Myalgische Encefalomyelitis/Chronisch Vermoeidheidssyndroom) kunnen infecties of stressfactoren, zoals polytrauma (meervoudig letsel), leiden tot acute ontsteking en abnormale immuunactivatie. Dit kan een reactie op gang brengen die ontstekingen remt, maar die de immuunrespons uit balans brengt en mogelijk auto-immuniteit (het aanvallen van eigen weefsel) veroorzaakt. Hierdoor ontstaan vaak fysiologische afwijkingen, zoals verstoorde darmflora en systemische (lichaamsbrede) ontsteking. Dit kan leiden tot een verstoord stollingssysteem, chronische endotheelitis (ontsteking van bloedvaten), vasoconstrictie (bloedvatvernauwing) en hypoxie (zuurstoftekort). Een slecht werkend energiemetabolisme en oxidatieve stress (celbeschadiging door vrije radicalen) dragen mogelijk ook bij aan ME/CVS. Deze processen kunnen geleidelijk het homeostatische evenwicht (interne balans) van het lichaam verstoren.
𝗗𝗮𝗿𝗺𝗱𝘆𝘀𝗯𝗶𝗼𝘀𝗲
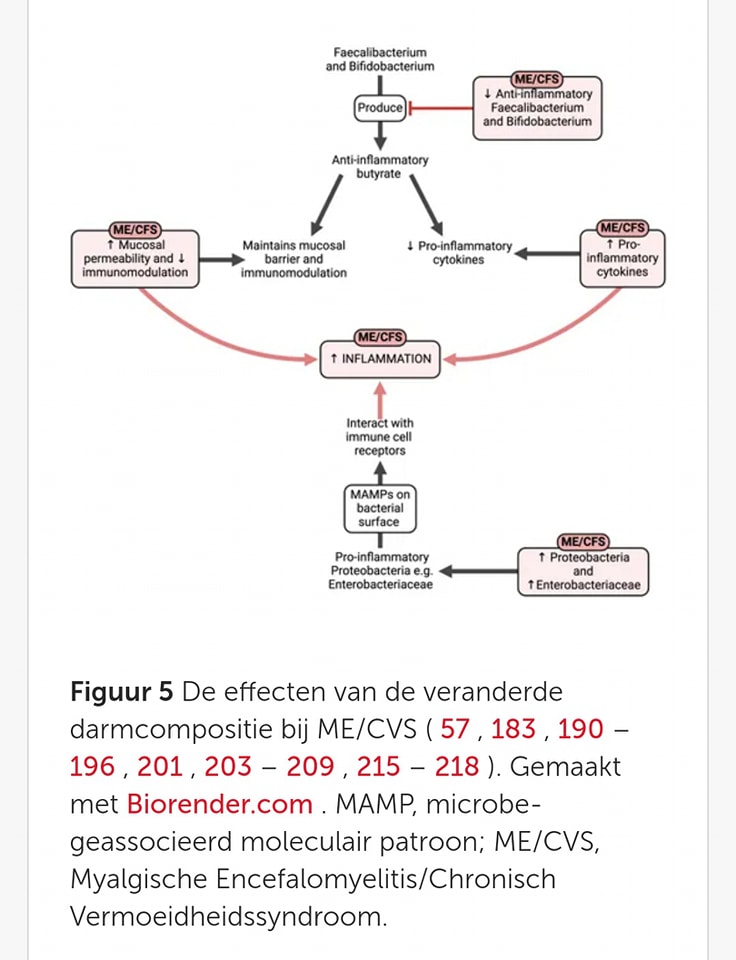
ME/CVS-patiënten hebben vaak gastro-intestinale symptomen zoals darmontsteking en verstoring van het darm microbioom. Er is een vermindering van de diversiteit van het microbioom vastgesteld, waarbij ontstekingsremmende bacteriën zoals Faecalibacterium en Bifidobacterium afnemen. Dit zorgt voor minder productie van butyraat, een ontstekingsremmende stof die belangrijk is voor het gezond houden van de darmwand en het regelen van het immuunsysteem. Tegelijkertijd zijn ontstekingsbevorderende bacteriën, zoals Proteobacteria en specifiek Enterobacteriaceae, toegenomen bij ME/CVS. Dit kan leiden tot een langzamere spijsvertering en symptomen die lijken op het prikkelbare darm syndroom (PDS). Het is echter nog niet duidelijk of een verstoorde darmflora de oorzaak is of het gevolg van ME/CVS.
𝗕𝗹𝗶𝗷𝘃𝗲𝗻𝗱𝗲 𝗮𝗮𝗻𝘄𝗲𝘇𝗶𝗴𝗵𝗲𝗶𝗱 𝘃𝗮𝗻 𝘇𝗶𝗲𝗸𝘁𝗲𝘃𝗲𝗿𝘄𝗲𝗸𝗸𝗲𝗿𝘀 𝗶𝗻 𝗰𝗲𝗹𝗹𝗲𝗻
Na een acute infectie kunnen ziekteverwekkers in de cellen achterblijven en ontsnappen ze aan het immuunsysteem. Deze ziekteverwekkers maken stoffen en eiwitten aan die de normale werking van de cellen verstoren, zoals het aflezen van DNA en de reparatie ervan. Door de gelijkenis van deze eiwitten met lichaamseigen eiwitten, wordt het voor het immuunsysteem moeilijker om de ziekteverwekker te herkennen. Dit zorgt voor een zwakkere immuunreactie en maakt het lichaam vatbaarder voor nieuwe infecties. Dit kan ook bijdragen aan de verschillende symptomen bij ME/CVS.
𝗠𝗶𝗰𝗿𝗼𝗯𝗲-𝗴𝗲𝗮𝘀𝘀𝗼𝗰𝗶𝗲𝗲𝗿𝗱𝗲 𝗺𝗼𝗹𝗲𝗰𝘂𝗹𝗮𝗶𝗿𝗲 𝗽𝗮𝘁𝗿𝗼𝗻𝗲𝗻 (𝗠𝗔𝗠𝗣𝘀)
Microbe-geassocieerde moleculaire patronen (MAMPs) zijn stoffen zoals lipopolysacharide (LPS) die een ontstekingsreactie kunnen veroorzaken door interactie met receptoren op immuuncellen. Bij ME/CVS zijn hogere niveaus van IgM- en IgA-antilichamen tegen LPS gevonden, evenals meer LPS en LPS-bindende eiwitten in het bloed. LPS, dat afkomstig is van bepaalde bacteriën, kan het immuunsysteem activeren en de bloedstolling beïnvloeden. Dit kan bijdragen aan systemische ontsteking bij ME/CVS doordat bacteriën en hun gifstoffen vanuit de darmen in het bloed terechtkomen. Hierdoor ontstaat darmontsteking en een lekkende darm, waarbij ook microben en virussen mogelijk in het bloed en de hersenen kunnen komen.
𝗗𝗮𝗿𝗺𝘃𝗶𝗿𝗼𝗼𝗺
Het darmviroom (verzameling van alle virussen in de darm), dat bestaat uit prokaryote virussen (virussen die bacteriën infecteren), zoals bacteriofagen (virussen die specifiek bacteriën aanvallen), speelt een rol in het reguleren van de bacteriën in de darm. Veranderingen in het viroom kunnen leiden tot een verstoring van het bacteriële evenwicht en de balans van het darmmicrobioom. Er is echter nog weinig onderzoek gedaan naar het viroom bij ME/CVS, en toekomstige studies zijn nodig om deze verbanden beter te begrijpen.
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲
Externe stressoren zoals infecties en toxische stoffen kunnen leiden tot chronische systemische en neuro-inflammatie bij ME/CVS. Ontstekingsmoleculen, vaak afkomstig van eerdere infecties en de daaruit voortvloeiende darmdysbiose, spelen een centrale rol in de symptomen en progressie van de ziekte. Verdere studies zijn nodig om de complexe interacties tussen immuunactivatie, darmdysbiose en ME/CVS-symptomen te verhelderen, wat kan bijdragen aan betere behandelingsstrategieën.
𝗦𝘆𝘀𝘁𝗲𝗺𝗶𝘀𝗰𝗵𝗲 𝗼𝗻𝘁𝘀𝘁𝗲𝗸𝗶𝗻𝗴 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦
Bij ME/CVS wordt aangenomen dat systemische en neuro-ontstekingen een cruciale rol spelen. Chronische ontsteking is een kenmerk van aanhoudende infectie, omdat infecties de aanmaak van pro- en anti-inflammatoire cytokinen (stoffen die ontstekingen bevorderen of verminderen) en chemokinen (stoffen die cellen aantrekken) kunnen veranderen. Dit past de ontstekings- en immuunreacties aan. Hoewel ontsteking wordt weerspiegeld in specifieke biomarkers, zijn traditionele ontstekingsmarkers zoals C-reactief proteïne (CRP) en de bezinkingssnelheid van erytrocyten (rode bloedcellen) ook vaak verhoogd bij ME/CVS, vooral bij mensen met een milde tot matige ziekte.
𝗖𝗶𝗿𝗰𝘂𝗹𝗲𝗿𝗲𝗻𝗱𝗲 𝗼𝗻𝘁𝘀𝘁𝗲𝗸𝗶𝗻𝗴𝘀𝗺𝗼𝗹𝗲𝗰𝘂𝗹𝗲𝗻
In de vroege stadia van ME/CVS worden vaak verhoogde pro-inflammatoire cytokinen (stoffen die ontstekingen bevorderen) aangetroffen, samen met een duidelijk ontstekingsprofiel. Deze verhoogde cytokinen zijn belangrijk voor het ontwikkelen van auto-immuunziekten. Deze stoffen zijn vooral gerelateerd aan Th1- en Th2-gedreven reacties (verschillende soorten immuunreacties), maar niet alle studies geven dezelfde resultaten.
Naarmate ME/CVS aanhoudt, veranderen het ontstekingsprofiel en de kenmerken van het immuunsysteem in het bloed. Dit suggereert dat het immuunsysteem in de vroege stadia actief probeert om de infectie aan te pakken. Echter, na verloop van tijd kunnen ziekteverwekkers (pathogenen) in het microbioom de immuunreactie onderdrukken, wat leidt tot immuunuitputting. Acute ziekteverwekkers kunnen dus chronische symptomen veroorzaken door in een slapende toestand te blijven.
𝗖𝘆𝘁𝗼𝗸𝗶𝗻𝗲-𝗮𝗰𝘁𝗶𝘃𝗮𝘁𝗶𝗲 𝗲𝗻 𝘇𝗶𝗲𝗸𝘁𝗲-𝗲𝗿𝗻𝘀𝘁
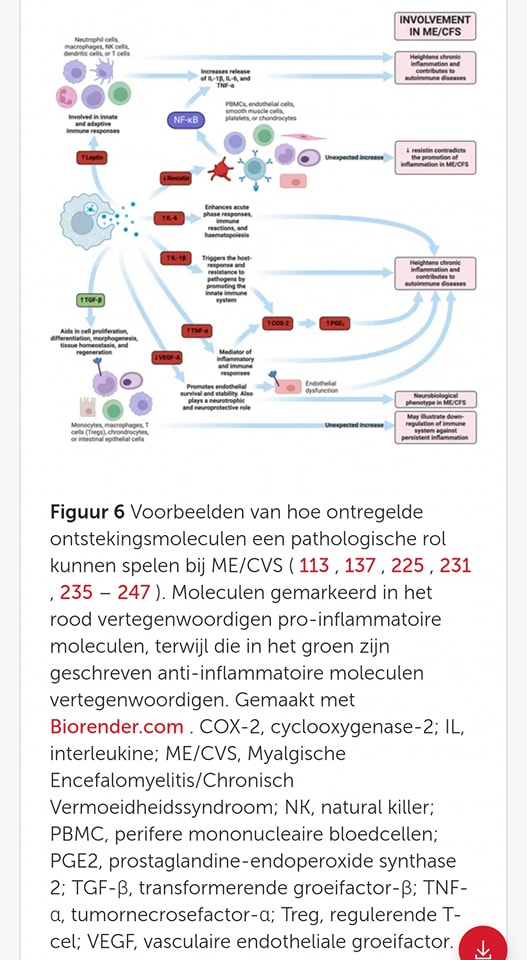
Bij ME/CVS-patiënten is cytokine-activatie waargenomen en lijkt deze toe te nemen met de ernst van de ziekte. Dit suggereert dat patiënten in de loop van de tijd met een toenemende infectielast kunnen worstelen. Eén studie vond dat 17 cytokinen een significante opwaartse trend vertoonden met de ernst van ME/CVS: CCL11 (Eotaxin-1), CXCL1 (GROα), CXCL10 (IP-10), IFN-γ, IL-4, IL-5, IL-7, IL-12p70, IL-13, IL-17F, leptine, G-CSF, GM-CSF, LIF, NGF, SCF en TGF-α. Van deze 17 cytokinen worden er 13 beschouwd als pro-inflammatoire cytokinen.
Hoewel deze 17 cytokinen (stoffen die ontstekingen beïnvloeden) een rechte relatie vertonen met de toenemende ernst van ME/CVS, waren er geen significante verschillen tussen de controle- en ME/CVS-groepen. Deze relatie tussen de niveaus van cytokinen en de ernst van de ziekte suggereert dat de ernst een nuttige manier kan zijn om ME/CVS te categoriseren. Het kan ook wijzen op een probleem in het metabolisme (de stofwisseling) of de uitscheiding van cytokinen.
Kortom, de bevindingen suggereren dat chronische en systemische ontstekingen een sleutelrol spelen bij ME/CVS, waarbij de ernst van de ziekte mogelijk gerelateerd is aan cytokine-activatie en immuunresponsen. Verdere studies zijn nodig om deze verbanden beter te begrijpen en om effectieve behandelingsstrategieën te ontwikkelen.
𝗥𝗲𝗱𝗼𝘅-𝗼𝗻𝗯𝗮𝗹𝗮𝗻𝘀 𝗲𝗻 𝗼𝘅𝗶𝗱𝗮𝘁𝗶𝗲𝘃𝗲 𝘀𝘁𝗿𝗲𝘀𝘀 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦

𝗢𝗻𝘁𝘀𝘁𝗲𝗸𝗶𝗻𝗴 𝗲𝗻 𝗿𝗲𝗱𝗼𝘅-𝗼𝗻𝗲𝘃𝗲𝗻𝘄𝗶𝗰𝗵𝘁𝗶𝗴𝗵𝗲𝗱𝗲𝗻
Ontsteking en redox-onevenwichtigheden zijn nauw met elkaar verbonden.
Redox verwijst naar de balans tussen oxidatie en reductie in je cellen. Oxidatie (afbraak door zuurstof) moet in balans zijn met reductie (herstel van cellen).
Ontstekingen zorgen voor het vrijkomen van schadelijke stoffen, zoals reactieve zuurstofsoorten (ROS) en reactieve stikstofsoorten (RNS). Tegelijkertijd kunnen verstoringen in de balans van bepaalde stoffen in het lichaam (redox-onevenwichtigheden) schade aan cellen veroorzaken, wat op zijn beurt weer ontstekingen uitlokt. Bij mensen met ME/CVS spelen deze onevenwichtigheden, samen met oxidatieve stress (te veel schadelijke zuurstofverbindingen), nitrosatieve stress (te veel schadelijke stikstofverbindingen), en schade door slechte bloedtoevoer (chronische ischemie-reperfusieschade), een belangrijke rol. Onderzoek toont aan dat er bij ME/CVS tekenen van oxidatieve stress zijn, die samenhangen met de ernst van de symptomen.
𝗡𝗶𝘁𝗿𝗼𝘀𝗮𝘁𝗶𝗲𝘃𝗲 𝘀𝘁𝗿𝗲𝘀𝘀
Bij ME/CVS is er ook sprake van nitrosatieve stress, wat betekent dat er te veel schadelijke stikstofverbindingen in het lichaam zijn. Dit blijkt uit verschillende signalen, zoals hogere niveaus van bepaalde enzymen (NOS), stikstofmonoxide (NO), en andere schadelijke stoffen zoals peroxynitriet. Ook worden er na inspanning hogere hoeveelheden nitraat en NF-κβ (een stof die ontstekingen kan bevorderen) gevonden. Hoewel stikstofmonoxide normaal gesproken helpt om de bloedvaten te verwijden en signalen in de hersenen door te geven, kan een teveel ervan schadelijk zijn. Dit komt omdat overtollig stikstofmonoxide en andere schadelijke stoffen antioxidanten in het lichaam, zoals het enzym catalase, aantasten, wat de chemische onbalans (redox-onbalans) verder verergert.
𝗦𝗽𝗶𝗲𝗿𝗮𝗳𝗳𝗲𝗿𝗲𝗻𝘁𝗲𝗻 𝗲𝗻 𝗵𝗲𝗮𝘁 𝘀𝗵𝗼𝗰𝗸 𝗲𝗶𝘄𝗶𝘁𝘁𝗲𝗻 (𝗛𝗦𝗣’𝘀)
Bij spiervermoeidheid worden bepaalde zenuwen in de spieren, genaamd spierafferenten (zenuwen die informatie van de spieren naar de hersenen sturen), actief. Dit zorgt ervoor dat er heat shock-eiwitten (HSP’s) worden aangemaakt. HSP’s zijn speciale eiwitten die spiercellen helpen beschermen tegen schade door schadelijke stoffen zoals reactieve zuurstofsoorten (ROS), die tijdens inspanning vrijkomen. HSP’s activeren antioxidanten die de spieren helpen herstellen, waardoor de hoeveelheid van deze beschermende eiwitten in het bloed (plasma) toeneemt. Echter, bij langdurige lichte inspanning kan door oxidatieve stress de aanmaak van HSP’s afnemen. Bij mensen met ME/CVS is de productie van HSP’s verminderd. Daarnaast zijn de reacties van de HSP’s HSP27 en HSP70, die normaal helpen bij het herstel van spiercellen, vertraagd of verlaagd. Ook zijn de rustniveaus van HSP70 in het bloed lager dan normaal, wat kan bijdragen aan de spierproblemen bij ME/CVS.
𝗚𝗲𝘃𝗼𝗹𝗴𝗲𝗻 𝘃𝗼𝗼𝗿 𝗠𝗘/𝗖𝗩𝗦-𝗽𝗮𝘁𝗶𝗲̈𝗻𝘁𝗲𝗻
De verminderde aanmaak van heat shock-eiwitten (HSP’s), samen met de aanwezigheid van oxidatieve stress (te veel schadelijke zuurstofverbindingen), nitrosatieve stress (te veel schadelijke stikstofverbindingen) en lichte, aanhoudende ontstekingen, kan verklaren waarom mensen met ME/CVS moeite hebben met inspanning en spierproblemen ervaren. Het ingewikkelde samenspel tussen ontstekingen, verstoringen in de balans van chemische reacties (redox-onevenwichtigheden), en de beschermende mechanismen van het lichaam draagt bij aan hoe ernstig de ziekte is en hoe deze zich ontwikkelt. Door beter te begrijpen hoe dit werkt, kunnen onderzoekers nieuwe behandelingen ontwikkelen die zich richten op het verminderen van oxidatieve en nitrosatieve stress en het verbeteren van de productie en werking van HSP’s.
𝗗𝗶𝘀𝗳𝘂𝗻𝗰𝘁𝗶𝗲 𝘃𝗮𝗻 𝗵𝗲𝘁 𝘃𝗮𝗮𝘁𝘀𝘁𝗲𝗹𝘀𝗲𝗹, 𝗲𝗻𝗱𝗼𝘁𝗵𝗲𝗲𝗹 𝗲𝗻 𝗰𝗼𝗮𝗴𝘂𝗹𝗮𝘁𝗶𝗲 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦
𝗩𝗮𝘀𝗰𝘂𝗹𝗮𝗶𝗿𝗲 𝗲𝗻 𝗲𝗻𝗱𝗼𝘁𝗵𝗲𝗹𝗶𝗮𝗹𝗲 𝘃𝗲𝗿𝗮𝗻𝗱𝗲𝗿𝗶𝗻𝗴𝗲𝗻
ME/CVS gaat vaak samen met aanhoudende ontsteking en immuuncelactivatie (verhoogde activiteit van afweercellen). Dit kan leiden tot vasculaire veranderingen (aanpassing van bloedvaten) en endotheliale schade (beschadiging van de binnenkant van bloedvaten). Door deze veranderingen raakt de autoregulatie van de bloedstroom verstoord. Dit betekent dat de bloedstroom de metabolische vraag (energiebehoefte) van de weefsels niet kan bijhouden. Het resultaat is weefselhypoxie (zuurstoftekort in weefsels) en ischemie/reperfusieschade (schade door zuurstoftekort en herstelde doorbloeding).
𝗘𝗻𝗱𝗼𝘁𝗵𝗲𝗹𝗶𝗮𝗹𝗲 𝘀𝗰𝗵𝗮𝗱𝗲 𝗲𝗻 𝗱𝘆𝘀𝗳𝘂𝗻𝗰𝘁𝗶𝗲
Endotheelcellen, die de binnenkant van bloedvaten bekleden, spelen een belangrijke rol in de regulatie van het immuunsysteem. Bij ME/CVS ervaren patiënten vaak endotheliale dysfunctie (slechte werking van de vaatwandcellen), wat kan leiden tot oxidatieve stress (schadelijke zuurstofreacties) en ontstekingen.
Deze dysfunctie komt voor in zowel de grote bloedvaten, wat wordt gemeten door flow-gemedieerde dilatatie (MKZ, het vermogen van bloedvaten om zich uit te zetten als reactie op verhoogde bloedstroom), als in de microcirculatie (de kleinste bloedvaten in het lichaam), waarbij de functie wordt getest met post-occlusieve reactieve hyperemie (de toename van bloedstroom na tijdelijke afsluiting van een bloedvat).
Bij ME/CVS-patiënten kunnen de bloedvaten niet goed verwijden (uitzetten), zelfs niet na toediening van nitroglycerine ( een middel om vaten te verwijden). Bovendien is het MIAT-gen ( myocardinfarct-geassocieerde transcript) verhoogd in bepaalde immuuncellen van ME/CVS-patiënten, wat ook wijst op endotheliale disfunctie.
𝗘𝗻𝗱𝗼𝘁𝗵𝗲𝗲𝗹-𝗼𝗻𝗮𝗳𝗵𝗮𝗻𝗸𝗲𝗹𝗶𝗷𝗸𝗲 𝗺𝗮𝗿𝗸𝗲𝗿𝘀
De gebruikelijke markers voor endotheeldisfunctie (slechte werking van bloedvatwanden) die vaak voorkomen bij hart- en vaatziekten, zoals SDMA en ADMA (stoffen die de bloedvaten vernauwen), hs-CRP (marker voor ontstekingen), en de niveaus van arginine en homoarginine (aminozuren die de bloedvaten helpen verwijden), komen niet overeen met de markers bij ME/CVS. Dit wijst erop dat er bij ME/CVS een ander mechanisme aan de hand is, namelijk een abnormale immuunrespons).
De endotheeldisfunctie bij ME/CVS kan leiden tot capillaire lekkage (vochtverlies in kleine bloedvaten), versnelde ontsteking (snellere immuunreacties), hypercoagulatie (verhoogde bloedstolling), aggregatie van bloedplaatjes (samenklontering van bloedcellen), en verminderde vasculaire tonus (minder spanning in de bloedvaten, wat de doorbloeding belemmert).
𝗥𝗼𝗹 𝘃𝗮𝗻 𝗺𝗶𝗰𝗿𝗼𝗥𝗡𝗔’𝘀 (𝗺𝗶𝗥𝗡𝗔’𝘀)
MiRNA’s, kleine stukjes genetisch materiaal, zijn cruciaal voor het behoud van een gezonde endotheliale functie (werking van bloedvatwanden) en kunnen dienen als biomarkers voor verschillende ziekten. Bij ME/CVS zijn er veranderingen in de miRNA-profielen waargenomen.
Deze miRNA’s beïnvloeden de Sirt1/eNOS-as . Deze Sirt1/eNOS-as is een signaalroute (reeks chemische processen in cellen) die betrokken is bij het reguleren van NO-productie of stikstofmonoxide, een stof die helpt de bloedvaten te verwijden). Veranderingen in specifieke miRNA’s, zoals miR-21, miR-34a, miR-92a, miR-126, en miR-200c, zijn bij ME/CVS gerelateerd aan signaalroutes die de endotheliale functie, zuurstofregulatie , en oxidatieve stress (schadelijke effecten van vrije radicalen) beïnvloeden.
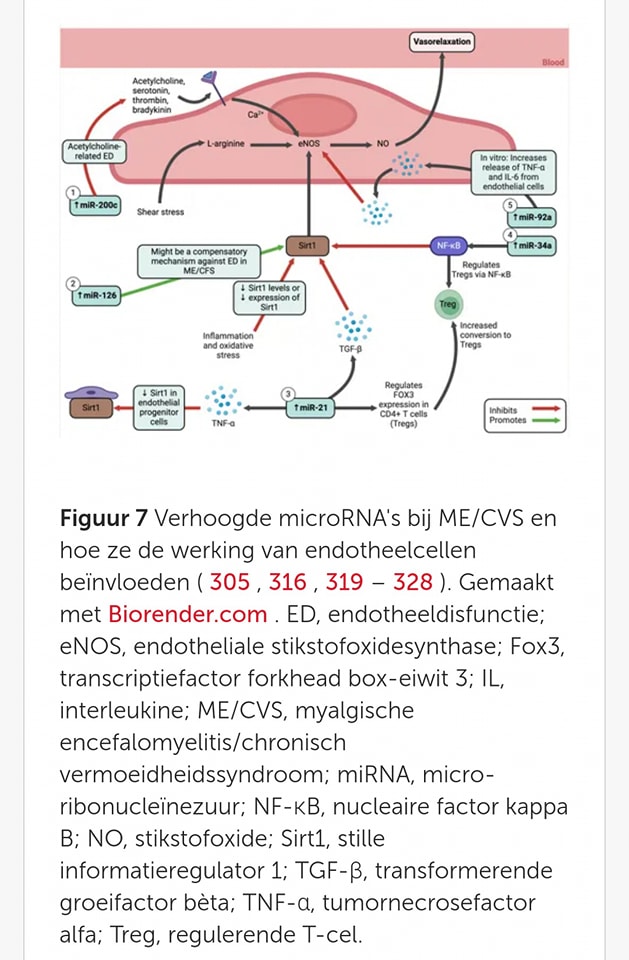
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲
Bij ME/CVS-patiënten veroorzaken vasculaire disfuncties (problemen met de bloedvaten) en endotheliale disfuncties (slechte werking van de vaatwanden) een complexe wisselwerking tussen ontsteking (immuunreactie), oxidatieve stress (schade door vrije radicalen) en de immuunrespons (afweerreactie van het lichaam). Deze processen dragen bij aan de diverse symptomen en de ernst van de ziekte. Door meer inzicht in deze mechanismen te krijgen, kunnen nieuwe behandelingen ontwikkeld worden die zich richten op het verbeteren van de endotheliale functie (bloedvatwerking) en het verminderen van oxidatieve stress (vrije radicalenschade) en ontsteking.
𝗔𝘂𝘁𝗼𝗻𝗼𝗺𝗲 𝗱𝘆𝘀𝗳𝘂𝗻𝗰𝘁𝗶𝗲, 𝘃𝗮𝘀𝗼𝗰𝗼𝗻𝘀𝘁𝗿𝗶𝗰𝘁𝗶𝗲 𝗲𝗻 𝗵𝘆𝗽𝗼𝘅𝗶𝗲 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦
𝗔𝘂𝘁𝗼𝗻𝗼𝗺𝗲 𝗱𝘆𝘀𝗳𝘂𝗻𝗰𝘁𝗶𝗲
Veel ME/CVS-patiënten ervaren cardiovasculaire veranderingen die wijzen op autonome dysfunctie. Een studie onder 131 ME/CVS-patiënten, gediagnosticeerd volgens de Fukuda-criteria, identificeerde vier groepen:
- 34% van de mensen vertoont sympathische symptomen (symptomen van het deel van het zenuwstelsel dat het lichaam activeert in stresssituaties), in combinatie met dysautonomie (wanorde in het autonome zenuwstelsel, dat de automatische functies van het lichaam regelt). Dit wordt vaak geassocieerd met ernstigere ziektebeelden.
- 5% van de mensen heeft alleen sympathische symptomen, zonder andere complicaties.
- 21% van de mensen heeft parasympathische symptomen, wat betekent dat het deel van het zenuwstelsel dat verantwoordelijk is voor rust en herstel is verstoord.
- 40% van de mensen vertoont een verstoord sympathovagaal evenwicht, wat inhoudt dat de balans tussen het sympathische en parasympathische systeem verstoord is. Dit kan leiden tot een combinatie van zowel rust- als stressgerelateerde symptomen.
Hoewel onderzoeken naar autonome disfunctie bij ME/CVS tegenstrijdige resultaten laten zien, wijst een meta-analyse van 64 studies op significante verschillen in hartslagparameters tussen ME/CVS-patiënten en gezonde controles. Patiënten met ME/CVS hebben doorgaans een hogere hartslag in rust, een lagere maximale/piekhartslag, hogere hartslagreacties bij orthostatische testen, en een lagere hartslag bij submaximale inspanning, dit is trainen net onder je maximale capaciteit. Daarnaast wijzen verschillen in hartslagvariabiliteit (HRV) op een chronisch hoge sympathische tonus (stressrespons) en verminderde vagale modulatie (ontspanning).
𝗩𝗮𝘀𝗼𝗰𝗼𝗻𝘀𝘁𝗿𝗶𝗰𝘁𝗶𝗲 𝗲𝗻 𝗵𝘆𝗽𝗼𝘅𝗶𝗲
De autonome veranderingen bij ME/CVS leiden waarschijnlijk tot vasoconstrictie (vernauwing bloedvaten) en hypoperfusie ( niet genoeg bloed naar bepaalde delen van het lichaam), wat een centrale rol speelt in de pathologie van de ziekte.
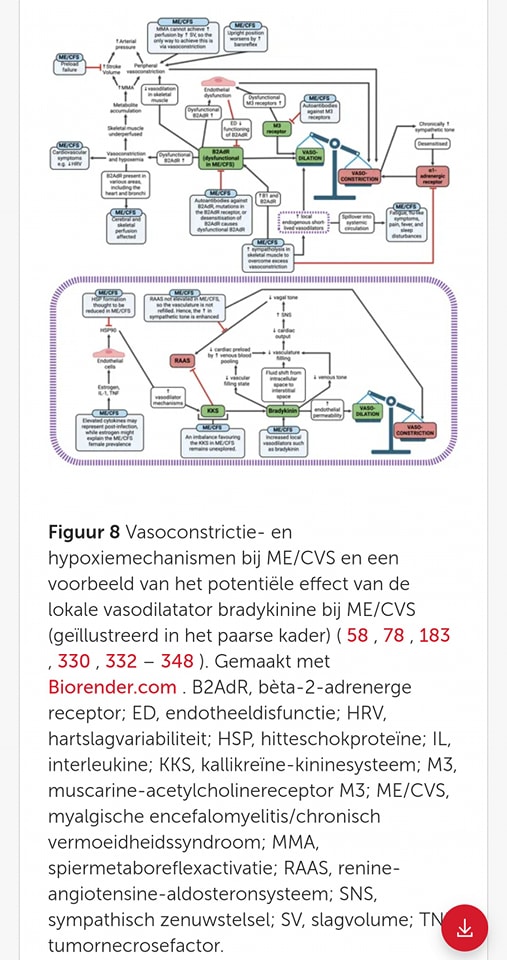
Endotheliale dysfunctie (slechte werking van de cellen aan de binnenkant van de bloedvaten), vaatdisfunctie (slecht functionerende bloedvaten) en microstolsels (kleine bloedpropjes) dragen bij aan de vasoconstrictie en zorgen ervoor dat weefsels te weinig zuurstof krijgen (weefselhypoxie). Wanneer de skeletspieren (de spieren die we gebruiken om te bewegen) niet genoeg bloed krijgen (hypoperfusie), kunnen er afvalstoffen (metabolieten) ophopen, wat een reactie in de spieren veroorzaakt, genaamd spiermetaboreflexactivatie (MMA).
Bij MMA stuurt het lichaam signalen naar het hart en de bloedvaten om harder te werken, zoals het verhogen van de hartslag of het vernauwen van de bloedvaten (vasoconstrictie), zodat de bloeddruk omhoog gaat en meer bloed naar de spieren kan stromen. Het doel van deze reflex is om de spieren te helpen herstellen en hun werk beter te doen tijdens inspanning. Echter, bij aandoeningen zoals ME/CVS werkt deze reflex niet altijd goed, waardoor het niet lukt om de bloedtoevoer voldoende te verhogen.
Bij ME/CVS-patiënten met preload-falen (problemen met het vullen van het hart met bloed), kan deze spierreflex (MMA) de bloedtoevoer naar de spieren niet voldoende verbeteren. Hierdoor probeert het lichaam de bloeddruk te behouden door de bloedvaten nog verder te vernauwen (verhoogde vasoconstrictie), wat de symptomen verergert. kan MMA de perfusie niet voldoende verhogen via een groter slagvolume, wat resulteert in verhoogde vasoconstrictie om de bloeddruk te handhaven.
Bij ME/CVS-patiënten wordt de situatie vaak erger als ze rechtop staan, omdat de baroreflex (een reactie van het lichaam om de bloeddruk te reguleren) ervoor zorgt dat de bloedvaten zich nog meer vernauwen (vasoconstrictie). Een slecht werkende B2AdR (beta-2 adrenerge receptor, een receptor die de bloedvaten normaal gesproken helpt verwijden) kan deze vernauwing verergeren doordat het de verwijding van bloedvaten (vasodilatatie) in de spieren belemmert.
Er zijn drie hoofdfactoren die bijdragen aan te veel vasoconstrictie bij ME/CVS:
- B2AdR-disfunctie (slecht functionerende beta-2 receptoren)
- Te sterke baroreflex door hypovolemie (laag bloedvolume)
- Te sterke MMA-activering (spierreflex die bloedtoevoer regelt) door slechte stofwisselingscondities in de spieren.
𝗖𝗵𝗿𝗼𝗻𝗶𝘀𝗰𝗵 𝗵𝗼𝗴𝗲 𝘀𝘆𝗺𝗽𝗮𝘁𝗵𝗶𝘀𝗰𝗵𝗲 𝘁𝗼𝗻𝘂𝘀
Bij mensen met ME/CVS is er vaak sprake van een chronisch hoge sympathische tonus (een overactief stresssysteem dat constant het lichaam in een staat van paraatheid houdt). Om te voorkomen dat dit leidt tot te sterke vernauwing van de bloedvaten (vasoconstrictie), is sympatholyse (het verminderen van de invloed van het sympathische zenuwstelsel) nodig in de spieren. Dit proces stimuleert de afgifte van vasodilatatoren (stoffen die bloedvaten helpen verwijden). Het gaat daarbij om stoffen als:
- Adenosine (een chemische stof die het hart en de bloedvaten helpt ontspannen).
- ATP (een energiedrager in cellen), prostaglandinen (stoffen die ontsteking en bloeddoorstroming reguleren).
- Prostacycline (een stof die bloedstolling voorkomt).
- Bradykinine (een peptide dat bloedvaten verwijdt.
- Protonen (die de zuurgraad van het bloed beïnvloeden).
Deze stoffen helpen het lichaam te compenseren voor de overmatige vasoconstrictie.
Echter, wanneer deze vasodilatatoren in de systemische circulatie (het algemene bloedstroomsysteem van het lichaam) terechtkomen, kunnen ze bijdragen aan typische ME/CVS-symptomen zoals vermoeidheid, pijn en slaapstoornissen. Dit wordt bijvoorbeeld duidelijk bij bradykinine, dat betrokken kan zijn bij verminderde bloedtoevoer naar de spieren door preload-falen (onvoldoende bloedvulling van het hart), wat vaker voorkomt bij ME/CVS-patiënten.
𝗔𝗯𝗻𝗼𝗿𝗺𝗮𝗹𝗲 𝘀𝘁𝗼𝗹𝗹𝗶𝗻𝗴 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦: 𝗱𝗲 𝗿𝗼𝗹 𝘃𝗮𝗻 𝗺𝗶𝗰𝗿𝗼𝘀𝘁𝗼𝗹𝘀𝗲𝗹𝘀 𝗲𝗻 𝗼𝗻𝘁𝘀𝘁𝗲𝗸𝗶𝗻𝗴𝘀𝗿𝗲𝗺𝗺𝗲𝗻𝗱𝗲 𝘀𝘁𝗼𝗳𝗳𝗲𝗻
𝗛𝘆𝗽𝗲𝗿𝗰𝗼𝗮𝗴𝘂𝗹𝗮𝘁𝗶𝗲 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦

Er wordt verondersteld dat hypercoagulatie (een verhoogde stolling van het bloed) een belangrijke rol speelt bij ME/CVS, hoewel verschillende onderzoeken niet altijd dezelfde resultaten laten zien. Daarom is meer onderzoek nodig om dit beter te begrijpen.
In één studie lieten bloedmonsters van ME/CVS-patiënten duidelijke tekenen van verhoogde stolling zien bij speciale tests genaamd trombo-elastografie (TEG), zowel in volbloed als in bloed zonder bloedplaatjes (cellen die helpen bij het stollen van bloed). Ook werd gezien dat bloedplaatjes hyperactief waren, en er waren kleine microstolsels aanwezig die fibrinogeen (een eiwit dat helpt bij stolling) en amyloïde (een eiwit dat kan ophopen in weefsels) bevatten. De oppervlakte van deze fibrinaloïde microstolsels was groter bij de ME/CVS-patiënten dan bij gezonde controles.
𝗜𝗻𝘃𝗹𝗼𝗲𝗱 𝘃𝗮𝗻 𝗟𝗣𝗦 𝗼𝗽 𝘀𝘁𝗼𝗹𝗹𝗶𝗻𝗴
Bij ME/CVS-patiënten zijn hogere niveaus van LPS-moleculen (lipopolysacchariden, een soort stof die ontstekingen kan veroorzaken) vastgesteld. Ook zijn er verhoogde niveaus van IgM- en IgA-antilichamen (afweerstoffen die het lichaam maakt tegen LPS) in het bloed.
LPS kan zich snel hechten aan plasma-eiwitten (eiwitten in het bloed), zoals fibrinogeen (een eiwit dat helpt bij stolling), wat de vorming van fibrinaloïde microstolsels bevordert. Dit betekent dat LPS niet alleen langdurige ontstekingen veroorzaakt door het maken van cytokines (stoffen die ontstekingen veroorzaken), maar ook een verhoogde stolling bevordert door zich te binden aan plasma-eiwitten.
𝗪𝗲𝗲𝗿𝘀𝘁𝗮𝗻𝗱 𝘁𝗲𝗴𝗲𝗻 𝗳𝗶𝗯𝗿𝗶𝗻𝗼𝗹𝘆𝘀𝗲 𝗲𝗻 𝗰𝗶𝗿𝗰𝘂𝗹𝗮𝘁𝗶𝗲𝗽𝗿𝗼𝗯𝗹𝗲𝗺𝗲𝗻
Deze fibrinaloïde microstolsels zijn vaak moeilijker af te breken door fibrinolyse (het proces waarbij stolsels worden afgebroken). Daardoor blijven ze langer in het bloed en hebben ze meer contact met het endotheel (de binnenkant van bloedvaten). Dit kan de bloedcirculatie verminderen en microcapillairen (kleine bloedvaatjes) verstoppen. Dit leidt tot ischemie (onvoldoende bloedtoevoer), wat veel symptomen van ME/CVS kan veroorzaken.
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲
Verhoogde stolling en de vorming van microstolsels spelen waarschijnlijk een belangrijke rol bij ME/CVS. De aanwezigheid van deze stolsels kan bijdragen aan symptomen zoals vermoeidheid, pijn en problemen met de bloedcirculatie. Dit gebeurt omdat de microvaten verstoppen en er minder zuurstof naar de weefsels gaat. Dit mechanisme benadrukt het belang van verder onderzoek naar de rol van stolling en ontsteking bij ME/CVS, wat kan leiden tot nieuwe inzichten en behandelingsmogelijkheden voor deze complexe aandoening.
𝗡𝗲𝘂𝗿𝗼-𝗼𝗻𝘁𝘀𝘁𝗲𝗸𝗶𝗻𝗴 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦: 𝗲𝗲𝗻 𝗱𝗶𝗲𝗽𝗴𝗮𝗮𝗻𝗱𝗲 𝗯𝗹𝗶𝗸
𝗩𝗲𝗿𝗵𝗼𝗼𝗴𝗱𝗲 𝗰𝘆𝘁𝗼𝗸𝗶𝗻𝗲𝘀 𝗲𝗻 𝗰𝗲𝗹𝗮𝗰𝘁𝗶𝘃𝗮𝘁𝗶𝗲
PET-scan bij ME/CVS-patiënten heeft aangetoond dat er verhoogde niveaus van cytokines (eiwitten die door cellen worden afgegeven om signalen door te geven aan andere cellen) aanwezig zijn in zowel het ruggenmerg als de hersenen. Daarnaast is er een verhoogde activiteit waargenomen van astrocyten en microglia, die beide belangrijke ondersteunende cellen zijn in het brein. Astrocyten zijn cellen die de hersenen ondersteunen en beschermen, micoglia zijn immuuncellen van het brein die afvalstoffen opruimen en reageren op schade.
Hoewel cytokines voornamelijk door het immuunsysteem worden geproduceerd, kunnen sommige ook in het centrale zenuwstelsel (CZS) worden aangemaakt. Dit wijst op een complex en nog niet volledig begrepen verband tussen neuro-inflammatie en perifere pro-inflammatoire cytokines (ontstekingsbevorderende eiwitten die buiten het centrale zenuwstelsel worden geproduceerd door immuuncellen).
𝗩𝗲𝗿𝘀𝘁𝗼𝗿𝗶𝗻𝗴 𝘃𝗮𝗻 𝗱𝗲 𝗯𝗹𝗼𝗲𝗱-𝗵𝗲𝗿𝘀𝗲𝗻𝗯𝗮𝗿𝗿𝗶𝗲̀𝗿𝗲 (𝗕𝗕𝗕)
Cytokines kunnen de bloed-hersenbarrière (BBB) verstoren, dit is de beschermende laag die schadelijke stoffen uit de hersenen houdt. Hierdoor kunnen pro-inflammatoire cytokines, immuuncellen zoals dendritische cellen, B-cellen en T-cellen, en zelfs darmmicroben of toxines de hersenen kunnen binnendringen. Dit proces bevordert ontstekingen in het CZS en kan leiden tot cognitieve disfunctie, een veel voorkomend symptoom bij ME/CVS.

𝗜𝗺𝗽𝗮𝗰𝘁 𝘃𝗮𝗻 𝗘𝗕𝗩-𝗱𝗨𝗧𝗣𝗮𝘀𝗲
In vitro onderzoek (uitgevoerd buiten het lichaam, bijvoorbeeld in een laboratorium) heeft laten zien dat het enzym EBV-dUTPase, dat wordt geproduceerd door het Epstein-Barr-virus, de activiteit van 34 genen beïnvloedt die belangrijk zijn voor het gezond houden van de bloed-hersenbarrière.
Dit betekent dat het EBV-dUTPase-enzym mogelijk veranderingen kan veroorzaken in de manier waarop hersencellen verbinding maken en met elkaar communiceren bij mensen met ME/CVS. Hierdoor kan de communicatie tussen zenuwcellen (neuronen) worden verstoord, wat negatieve gevolgen heeft voor cognitieve processen.
𝗔𝘂𝘁𝗼𝗿𝗲𝗴𝘂𝗹𝗮𝘁𝗶𝗲 𝘃𝗮𝗻 𝗱𝗲 𝗯𝗹𝗼𝗲𝗱𝘀𝘁𝗿𝗼𝗼𝗺 𝗲𝗻 𝗵𝘆𝗽𝗼𝘅𝗶𝗲
Ontstekingsgerelateerde veranderingen kunnen de autoregulatie van de bloedstroom in de hersenen verminderen, wat leidt tot hypoperfusie (onvoldoende doorbloeding) in de hersenstam en hypoxie (zuurstoftekort) van het hersenweefsel. Dit draagt bij aan de symptomen van ME/CVS, waaronder cognitieve disfunctie en post-exertionele malaise (PEM).
𝗖𝗲𝗿𝗲𝗯𝗿𝗮𝗹𝗲 𝗯𝗹𝗼𝗲𝗱𝘀𝘁𝗿𝗼𝗼𝗺 𝗲𝗻 𝗶𝗻𝘁𝗿𝗮𝗰𝗿𝗮𝗻𝗶𝗮𝗹𝗲 𝗱𝗿𝘂𝗸
Kanteltests bij ME/CVS-patiënten hebben aangetoond dat ze een verminderde cerebrale bloedstroom (minder bloed naar hun hersenen) en verhoogde intracraniale (in het hoofd) druk hebben. Deze veranderingen kunnen ervoor zorgen dat het lichaam moeilijker de balans kan vinden tussen twee systemen die belangrijk zijn voor de regulatie van ons lichaam; sympathische activiteit (helpt het systeem om te reageren op stress en gevaar door bijvoorbeeld hartslagverhoging) en parasympathische activiteit (zorgt dat ons lichaam tot rust komt en herstelt door bijvoorbeeld hartslagverhoging). Ook kunnen deze veranderingen leiden tot PEM en cognitieve disfunctie.
𝗜𝗻𝘁𝗲𝗿𝗮𝗰𝘁𝗶𝗲 𝗺𝗲𝘁 𝗻𝗲𝘂𝗿𝗼𝘁𝗿𝗮𝗻𝘀𝗺𝗶𝘁𝘁𝗲𝗿𝘀 𝗲𝗻 𝘃𝗮𝘀𝗰𝘂𝗹𝗮𝗶𝗿𝗲 𝗱𝗶𝘀𝗳𝘂𝗻𝗰𝘁𝗶𝗲
Neuro-inflammatie kan ook invloed hebben op neurotransmitters (chemische stoffen die signalen tussen zenuwcellen in onze hersenen overbrengen), procoagulante activiteit (proces dat de bloedstolling bevordert) en trombose (vorming van bloedstolsels in de bloedvaten) verhogen, en endotheliale schade (aan de binenbekleding van de bloedvaten) veroorzaken. Dit resulteert in disfunctie van de neurovasculaire koppeling (NVC), wat bijdraagt aan de complexiteit en ernst van ME/CVS-symptomen.
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲
Neuro-ontsteking speelt een centrale rol bij de pathologie van ME/CVS. Verhoogde cytokines en activering van hersencellen, verstoring van de BBB, en veranderingen in de bloedstroom en zuurstoftoevoer naar de hersenen dragen allemaal bij aan de symptomen van deze aandoening. Verder onderzoek naar deze processen kan helpen bij het ontwikkelen van effectieve behandelingen en het verbeteren van de kwaliteit van leven voor ME/CVS-patiënten.
𝗩𝗲𝗿𝗺𝗶𝗻𝗱𝗲𝗿𝗱 𝗲𝗻𝗲𝗿𝗴𝗶𝗲𝗺𝗲𝘁𝗮𝗯𝗼𝗹𝗶𝘀𝗺𝗲 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦
𝗚𝗲𝘀𝘁𝗿𝗲𝘀𝘁 𝗺𝗲𝘁𝗮𝗯𝗼𝗹𝗶𝘀𝗺𝗲 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦
Patiënten met ME/CVS ervaren een gestrest metabolisme, (stofwisselingssysteem) zonder een duidelijk metabolisch fenotype (stofwisselingsprofiel). Wanneer de balans homeostase (balans van het lichaam) wordt bedreigd door infectie, hypoxie (zuurstoftekort) of ondervoeding, beïnvloeden immuun- en ontstekingsprocessen de energie en het metabolisme. Bij ME/CVS kan deze energiebelasting ontstaan door inspanningsgevoelige weefselhypoxie (zuurstoftekort in de weesfels), wat leidt tot aanpassingen en compensaties in het gehele stofwisselingssysteem. Na verloop van tijd lijkt de ziekte te verschuiven van een hypermetabolische (overactieve stofwisseling) naar een hypometabolische (lage stofwisseling) toestand met verminderde energieproductie.
𝗠𝗶𝘁𝗼𝗰𝗵𝗼𝗻𝗱𝗿𝗶𝗮𝗹𝗲 𝗱𝘆𝘀𝗳𝘂𝗻𝗰𝘁𝗶𝗲

Mitochondriale dysfunctie (slechte werking van energieproducerende celstructuren) is een opvallend kenmerk bij ME/CVS. Deze dysfunctie verergert ontstekings en redox (verstoringen in balans van oxidatie en reductie) onevenwichtigheden door activatie van het NLRP3-inflammasoom (eiwitcomplex dat ontsteking start), wat leidt tot de afgifte van inflammatoire cytokines (ontstekingsbevorderende boodschapperstoffen) zoals IL-1β en IL-18. Beschadigde mitochondriën geven mtDNA (mitochondriaal DNA) vrij in het cytosol (vloeistof binnen de cel), wat het aangeboren immuunsysteem activeert via schade-geassocieerde moleculaire patronen (DAMPs, boodschappermoleculen die wijzen op celbeschadiging), en de adaptieve immuunresponsen (verworven immuunsysteem) moduleert. Bovendien verhoogt mitochondriale schade de ROS-niveaus (reactieve zuurstofsoorten die cellen kunnen beschadigen), wat mtDNA en eiwitten in de elektronentransportketen (ETC, keten die energie produceert in mitochondriën) kan beschadigen, resulterend in verlaagde ATP-productie (celenergie) en energieniveaus.
𝗦𝘁𝗿𝘂𝗰𝘁𝘂𝗿𝗲𝗹𝗲 𝗲𝗻 𝗳𝘂𝗻𝗰𝘁𝗶𝗼𝗻𝗲𝗹𝗲 𝘃𝗲𝗿𝗮𝗻𝗱𝗲𝗿𝗶𝗻𝗴𝗲𝗻
Structurele mitochondriale afwijkingen zijn waargenomen in spierbiopten van ME/CVS-patiënten, hoewel andere onderzoeken dit niet bevestigen. In bloedcellen van ME/CVS-patiënten werden meer gecondenseerde mitochondriale cristae (vouwingen in de binnenwand van mitochondriën die helpen bij energieproductie) waargenomen, terwijl de lengte, grootte, vorm, dichtheid, membraanpotentiaal (elektrische lading over de celwand) en enzymatische activiteiten van de elektronentransportketen (ETC-complexen, een reeks eiwitten die energie produceren) intact bleven. In CD4+ T-cellen (afweercellen die een rol spelen in het immuunsysteem) was de mitochondriale massa (hoeveelheid mitochondriën) niet veranderd bij ME/CVS.
𝗠𝗲𝘁𝗮𝗯𝗼𝗹𝗶𝘀𝗰𝗵𝗲 𝗮𝗳𝘄𝗶𝗷𝗸𝗶𝗻𝗴𝗲𝗻
ME/CVS-patiënten vertonen verschillende metabole afwijkingen, zoals verminderde mitochondriale ademhalingsfunctie bij neutrofielen en PBMC’s. Hoewel de mitochondriale ademhaling onveranderd was in rustende en gestimuleerde CD4+- en CD8+T-cellen, vertoonden CD8+T-cellen een vermindering van protonlek, ATP-synthese en mitochondriale membraanpotentiaal. Verminderde ATP-productie is ook waargenomen in lymfoblasten en PBMC’s. Bovendien is een verminderde glycolyse waargenomen in CD8+T-cellen in rust en na activering, CD4+T-cellen in rust, bloed- en urinemonsters en PBMC’s. NK-cellen van ME/CVS-patiënten tonen een verminderde glycolytische reserve, en metabolomische analyses onthullen een gecompromitteerde ATP-productie via de tricarbonzuurcyclus (TCA).
𝗔𝗻𝗮𝗲𝗿𝗼𝗯𝗲 𝗺𝗲𝘁𝗮𝗯𝗼𝗹𝗶𝘀𝗺𝗲 𝗲𝗻 𝘃𝗲𝗿𝗵𝗼𝗼𝗴𝗱 𝗺𝗲𝗹𝗸𝘇𝘂𝘂𝗿
Wanneer het aërobe metabolisme (energieproductie met zuurstof) verstoord is, schakelt het lichaam over op anaerobe productie (energieproductie zonder zuurstof, wat 18 keer minder ATP (energiebron van cellen) per glucosemolecuul aanmaakt en meer melkzuur (bijproduct van anaerobe stofwisseling) produceert. Tweedaagse cardiopulmonale inspanningstesten (CPET, test voor hart- en longfunctie tijdens inspanning) hebben een verlaagde anaerobe drempel bij ME/CVS aangetoond. Verhoogde lactaatniveaus (melkzuurniveaus) zijn gevonden in bloed, hersenvocht en spieren van ME/CVS-patiënten, wat wijst op verminderde oxidatieve fosforylatie (proces van energieproductie met gebruik van zuurstof in de mitochondriën) en een omschakeling naar anaerobe glycolyse (afbraak van glucose zonder zuurstof). Verhoogd serumlactaatdehydrogenase (een enzym dat wijst op weefselbeschadiging) duidt op weefselvernietiging.
𝗩𝗲𝗿𝗮𝗻𝗱𝗲𝗿𝗱 𝗴𝗲𝗯𝗿𝘂𝗶𝗸 𝘃𝗮𝗻 𝗮𝗺𝗶𝗻𝗼𝘇𝘂𝗿𝗲𝗻 𝗲𝗻 𝘃𝗲𝘁𝘇𝘂𝗿𝗲𝗻
ME/CVS-patiënten vertonen een veranderd gebruik van aminozuren en vetzuren als katabolische brandstof (brandstof die vrijkomt bij het afbreken van stoffen voor energie). Veranderde PDH-activiteit bij ME/CVS leidt tot verhoogd aminozuurgebruik als energiebron. PHD is een afkorting voor pyruvaatdehydrogenase, een enzym dat pyruvaat omzet in acetyl-CoA, wat essentieel is voor de citroenzuurcyclus, een proces waarin acetyl-CoA wordt gebruikt om energie te produceren door het omzetten van brandstoffen in ATP en kooldioxide. Metabolomische onderzoeken (onderzoek naar de producten die ontstaan door de stofwisseling) tonen veranderde cellulaire energieën aan, hoewel de aangetaste metabolieten verschillen tussen onderzoeken. Lagere niveaus van acylcarnitine (een stof betrokken bij vetzuurtransport), vetzuren en aminozuren uit de ureumcyclus (cyclus voor het afbreken van eiwitten) wijzen op een metabolische verschuiving in energieopslag, mobilisatie en gebruik.
𝗖𝗲𝗹𝗹𝘂𝗹𝗮𝗶𝗿𝗲 𝗴𝗲𝘃𝗮𝗮𝗿𝗿𝗲𝗮𝗰𝘁𝗶𝗲 𝗲𝗻 𝗴𝗲𝗶̈𝗻𝘁𝗲𝗴𝗿𝗲𝗲𝗿𝗱𝗲 𝘀𝘁𝗿𝗲𝘀𝘀𝗿𝗲𝗮𝗰𝘁𝗶𝗲
Deze energiestoornis kan resulteren in een hypometabolische toestand (verlaagde stofwisseling), ook wel de ‘celgevaarreactie’ genoemd, als gevolg van aanhoudende stressfactoren zoals redox-onevenwicht, aanhoudende infectie, letsel of onvoldoende voedingsstoffen. Dit beschermende mechanisme vermindert niet-essentiële energieverslindende processen om energiemoleculen beschikbaar te maken voor cruciale overlevingsmechanismen. Neuro-ontsteking of koorts kan ook de geïntegreerde stressreactie (ISR) (fysiologische reactie van het lichaam die ontstekingen en aanpassingen in metabolisme bevordert om de overleving te ondersteunen) veroorzaken, waarbij systemische ontsteking (lichaamsbrede ontstekingsreactie) een respons is op aanhoudende infectie of letsel.
Hoewel mitochondriale disfunctie duidelijk aanwezig lijkt bij ME/CVS, blijven de oorzaken onduidelijk en is er inconsistent bewijs voor een direct verband tussen mitochondriale dysfunctie en ME/CVS. De rol van mitochondriën in het reguleren van de intracellulaire calciumhomeostase (calciumbalans) in cellen en immuunprocessen suggereert dat deze mechanismen ook verstoord kunnen zijn bij ME/CVS. Verdere studies zijn nodig om de onderliggende oorzaken en mogelijke behandelingen beter te begrijpen.
𝗛𝗼𝗿𝗺𝗼𝗻𝗮𝗹𝗲 𝘃𝗲𝗿𝗮𝗻𝗱𝗲𝗿𝗶𝗻𝗴𝗲𝗻 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦

𝗥𝗼𝗹 𝘃𝗮𝗻 𝗱𝗲 𝗛𝗣𝗔-𝗮𝘀 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦
Stress wordt beschouwd als een mogelijke trigger voor ME/CVS en een oorzaak van symptoomopflakkeringen, waarbij de hypothalamus-hypofyse-bijnier-as (HPA-as, het stressregelingssysteem) een centrale rol speelt. Dit neurobiologische stresssysteem kan afwijkingen in de groeihormoon (GH) secretie en adrenerge metabolisme (stofwisseling van adrenaline) veroorzaken. De HPA-as helpt immuun- en ontstekingsreacties in het bloed om auto-immuunveranderingen te voorkomen. Bij aanhoudende stress wordt de HPA-as chronisch geactiveerd, wat leidt tot overproductie van cortisol en uiteindelijk tot verlaagde cortisolspiegels. Dit hypocortisolisme kan bijdragen aan de vermoeidheidssymptomen bij ME/CVS.
𝗖𝗼𝗿𝘁𝗶𝘀𝗼𝗹 𝗲𝗻 𝗶𝗺𝗺𝘂𝘂𝗻𝘀𝘆𝘀𝘁𝗲𝗲𝗺
Chronische activering van de HPA-as verhoogt de cortisolproductie, wat de immuunreacties en de productie van pro-inflammatoire cytokines (ontstekingsbevorderende eiwitten) verlaagt. In de loop van de tijd reageert de HPA-as op verhoogde cortisolspiegels door de cortisolproductie te verminderen, wat de bescherming van de HPA-as vermindert en ME/CVS-patiënten kwetsbaarder maakt voor stress. Dit fenomeen wordt vaak beschreven als een ‘stresscrash’ of ‘bijnierburn-out’, hoewel deze termen geen officiële medische diagnoses zijn.
𝗛𝗼𝗿𝗺𝗼𝗻𝗮𝗹𝗲 𝗮𝗳𝘄𝗶𝗷𝗸𝗶𝗻𝗴𝗲𝗻
ME/CVS-patiënten vertonen vaak lagere niveaus van adrenocorticotropine (ACTH, een hormoon dat de bijnieren stimuleert om cortisol te maken) en cortisol. Daarnaast is de piek van groeihormoon (GH) en insuline-achtige groeifactor-1 (IGF-1, eiwit voor celgroei) significant verminderd bij ernstige ME/CVS-patiënten vergeleken met controles en milde ME/CVS-patiënten. GH en IGF-1 spelen belangrijke rollen in neuroprotectie, mitochondriale bescherming, antioxidantverdediging en het verminderen van CZS-ontsteking (ontsteking van het centrale zenuwstelsel). Een afname van deze hormonen kan de positieve effecten verminderen.
𝗦𝗲𝗿𝗼𝘁𝗼𝗻𝗶𝗻𝗲 𝗲𝗻 𝗱𝗼𝗽𝗮𝗺𝗶𝗻𝗲
Serotonine speelt een rol in het centrale zenuwstelsel en reguleert stressmechanismen zoals de HPA-as door stimulatie van corticotropine-releasing hormoon (CRH, dit stimuleert de afgifte van ACTH dat weer de afgifte van corticosteroïden reguleert). Er wordt gesuggereerd dat de productie en recycling van dopamine en serotonine bij ME/CVS betrokken zijn. Excessieve serotonineniveaus kunnen klassieke symptomen van ME/CVS verklaren, zoals hyperalgesie (verhoogde pijngevoeligheid), cognitieve disfunctie en slaapproblemen, door overmatige CRH-afgifte en chronische HPA-as activatie. Verlaagde dopamineniveaus worden in verband gebracht met vermoeidheid, een veelvoorkomend symptoom bij ME/CVS.
𝗧𝗼𝘅𝗶𝗻𝗲𝗻 𝗲𝗻 𝗵𝗼𝗿𝗺𝗼𝗻𝗲𝗻
Blootstelling aan toxinen zoals organofosfaten, die cholinesteraseremmers zijn, verlengt en versterkt de effecten van acetylcholine. Acetylcholine bevordert de GH-secretie, maar bij toxineblootstelling kan de GH-respons op pyridostigmine verhoogd zijn. Dit kan wijzen op verhoogde gevoeligheid van somatotrofen voor GHRH of hyperresponsiviteit van cholinerge receptoren in de hypothalamus.
𝗛𝘆𝗽𝗼𝘁𝗵𝗮𝗹𝗮𝗺𝘂𝘀 𝗱𝘆𝘀𝗳𝘂𝗻𝗰𝘁𝗶𝗲
Symptomen zoals veranderingen in lichaamsgewicht, eetlust, vochtretentie en onregelmatige menstruatie wijzen op hypothalamusdisfunctie bij ME/CVS. Opregulatie van 5-hydroxytryptamine (5-HT) receptoren en abnormale reacties op arginine/vasopressine-tests suggereren hypothalamusproblemen. Auto-immuniteit van de hypothalamus/hypofyse kan ook voorkomen, vooral bij ernstige gevallen van ME/CVS, zoals blijkt uit de aanwezigheid van antihypofyse- en antihypothalamus-antilichamen.
𝗗𝗮𝗿𝗺𝗴𝗲𝘇𝗼𝗻𝗱𝗵𝗲𝗶𝗱 𝗲𝗻 𝗛𝗣𝗔-𝗮𝘀
Verhoogde darmpermeabiliteit kan ervoor zorgen dat microben en antigenen de epitheliale barrière passeren naar het omliggende weefsel en bloed, mogelijk de bloed-hersenbarrière (BBB) passeren en de HPA-as beïnvloeden. Dit suggereert dat GI-dysbiose de activering van de HPA-as kan bevorderen.
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲
Hormonale veranderingen spelen een significante rol bij ME/CVS, waarbij de HPA-as, cortisol, GH/IGF-1, serotonine en dopamine betrokken zijn. Deze veranderingen kunnen bijdragen aan de vermoeidheid en andere symptomen die ME/CVS kenmerken. Begrip van deze hormonale dysfuncties kan leiden tot betere behandelingsopties voor ME/CVS-patiënten.
𝗜𝗺𝗺𝘂𝘂𝗻𝗱𝗶𝘀𝗳𝘂𝗻𝗰𝘁𝗶𝗲 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦
𝗩𝗲𝗿𝗯𝗮𝗻𝗱 𝗺𝗲𝘁 𝗶𝗻𝗳𝗲𝗰𝘁𝗶𝗲𝘀
Een van de meest ondersteunde theorieën voor de oorsprong van ME/CVS is dat het wordt veroorzaakt door een bacteriële of virale infectie. Deze infecties zouden immuunontregeling kunnen veroorzaken, wat leidt tot chronische symptomen door interferentie (verstoring) met de genexpressie (genactiviteit), immuniteit en het metabolisme (energieverbruik) van de persoon die ziek is.
𝗩𝗲𝗿𝗮𝗻𝗱𝗲𝗿𝗶𝗻𝗴𝗲𝗻 𝗶𝗻 𝗶𝗺𝗺𝘂𝘂𝗻𝗰𝗲𝗹𝗹𝗲𝗻
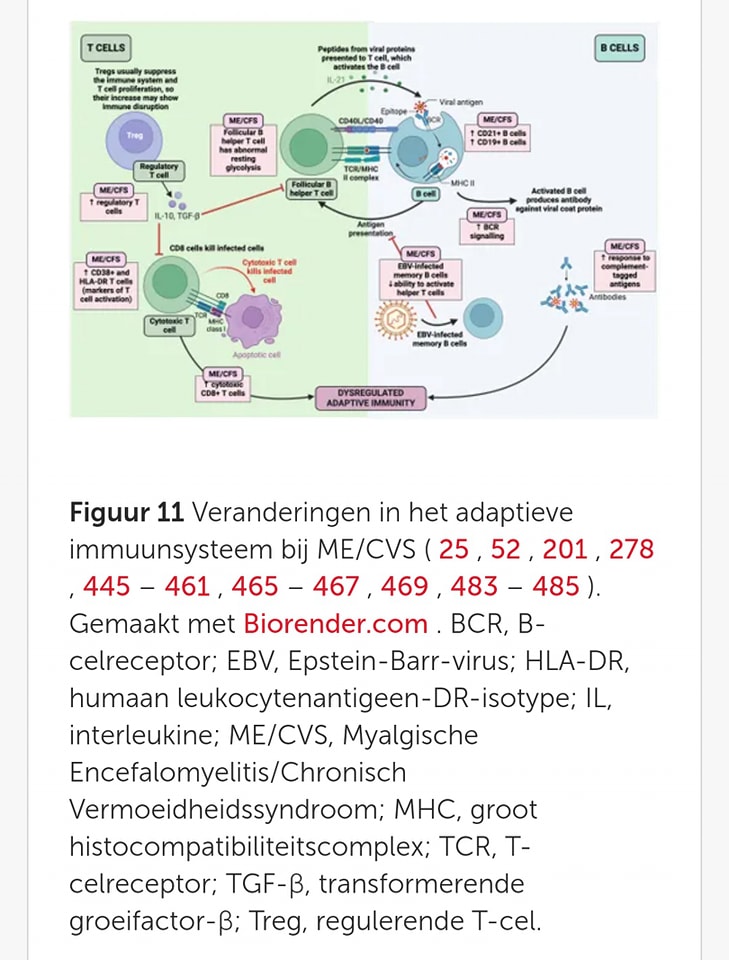
Er is bewijs dat een infectie een rol speelt bij het ontstaan van ME/CVS. Dit blijkt uit veranderingen in het aantal en de functie van verschillende immuuncellen (afweercellen), immuunprofielen (het totale afweerpatroon) en immuunparameters (signalen van een auto-immuunreactie). Deze abnormale immuunreacties zijn meer uitgesproken in de eerste drie jaar van de ziekte. Na verloop van tijd lijken deze afwijkingen te verminderen, wat suggereert dat de overactieve immuunrespons uitgeput raakt of wordt gereguleerd door tegenwerkende mechanismen. Dit kan verklaren waarom auto-immuunsymptomen vaak voorkomen bij ME/CVS, aangezien het verband tussen infecties en auto-immuunziekten goed is gedocumenteerd.
𝗜𝗻𝗰𝗼𝗻𝘀𝗶𝘀𝘁𝗲𝗻𝘁𝗶𝗲𝘀 𝗶𝗻 𝗶𝗺𝗺𝘂𝘂𝗻𝗿𝗲𝘀𝗽𝗼𝗻𝘀𝗲𝗻
Het meten van de aangeboren en adaptieve immuunresponsen (afweer die zich aanpast aan indringers) bij ME/CVS-patiënten heeft geleid tot tegenstrijdige resultaten. Hoewel immuundisfunctie duidelijk aanwezig is, zijn er verdere studies nodig om specifieke patronen te bepalen. Deze studies zouden gebruik moeten maken van gedefinieerde cohorten (patiëntengroepen), gestandaardiseerde tests en nieuwe technologieën.
𝗕𝗲𝗵𝗮𝗻𝗱𝗲𝗹𝗶𝗻𝗴 𝗲𝗻 𝗵𝘆𝗽𝗼𝘁𝗵𝗲𝘀𝗲𝗻
Antivirale geneesmiddelen zijn niet succesvol gebleken bij de behandeling van ME/CVS, wat de hypothese tegenspreekt dat ME/CVS wordt veroorzaakt door een mislukte klaring van pathogene microben (onvoldoende verwijdering van ziektekiemen). Dit spreekt de theorie tegen dat ME/CVS wordt veroorzaakt door het niet kunnen opruimen van schadelijke microben (ziekteverwekkers). Een andere theorie is dat ME/CVS ontstaat door een foutieve afweerreactie op een eerdere infectie, waardoor een chronische auto-immuunziekte ontstaat door moleculaire nabootsing (immuunsysteem vergist zich door gelijkenis). Dit wordt de ‘hit and run’-hypothese genoemd.
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲
Immuundisfunctie speelt een cruciale rol bij ME/CVS, mogelijk getriggerd door bacteriële of virale infecties. Veranderingen in immuuncellen en immuunprofielen suggereren een complexe interactie tussen infecties en immuunresponsen. Ondanks duidelijke tekenen van immuundisfunctie, blijven de exacte mechanismen onduidelijk en is verder onderzoek nodig om effectieve behandelingen te ontwikkelen.
𝗔𝘂𝘁𝗼-𝗶𝗺𝗺𝘂𝗻𝗶𝘁𝗲𝗶𝘁 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦
𝗢𝗽𝗿𝗲𝗴𝘂𝗹𝗮𝘁𝗶𝗲 𝘃𝗮𝗻 𝗮𝘂𝘁𝗼-𝗶𝗺𝗺𝘂𝘂𝗻𝗴𝗲𝗻𝗲𝗻
Bij ME/CVS-patiënten zijn bepaalde genen, zoals de HLA-allelen (genetische varianten die immuuncellen helpen eigen lichaamscellen van indringers te onderscheiden), geassocieerd met auto-immuniteit. Een verhoogde prevalentie van het HLA-DQB*01 allel en varianten van HLA-DQB1 in combinatie met RAGE-374A varianten is gevonden. Hoewel het mechanistische verband (onderliggende processen die oorzaak en effect verklaren) tussen HLA-II-allelexpressie en de ontwikkeling van ME/CVS nog onduidelijk is, suggereren single-nucleotide polymorfismen (SNP’s, kleine genetische variaties) in receptoren, enzymen en transcriptiefactoren (genregulerende eiwitten) dat genetische veranderingen in de ontwikkeling van T-cellen (afweercellen), B-cellen (antistoffen producerende cellen) of cytokinesignalering (communicatie tussen immuuncellen) kunnen bijdragen aan auto-immuunziekten.

𝗥𝗼𝗹 𝘃𝗮𝗻 𝗶𝗻𝗳𝗲𝗰𝘁𝗶𝗲𝘂𝘇𝗲 𝗺𝗼𝗻𝗼𝗻𝘂𝗰𝗹𝗲𝗼𝘀𝗶𝘀
Infectieuze mononucleosis (klierkoorts), veroorzaakt door EBV (het Epstein-Barr-virus), is een risicofactor voor verschillende auto-immuunziekten en kan een rol spelen bij ME/CVS. Bij sommige ME/CVS-patiënten is een opregulatie (toegenomen activiteit) van het door EBV geactiveerde gen 2 waargenomen, wat verschillende neurologische en immuungerelateerde symptomen kan verklaren. Daarnaast is verhoogde IgG-reactiviteit (afweerrespons) tegen een EBV-herhalingssequentie (een herhaald stuk DNA in het genoom van het Epstein-Barr-virus), EBNA-6, gedocumenteerd, wat wijst op mogelijke antigene nabootsing (immuunverwarring tussen lichaamseigen en virus). Infectieuze mononucleosis, veroorzaakt door EBV, is een risicofactor voor verschillende auto-immuunziekten en kan een rol spelen bij ME/CVS.
𝗔𝗮𝗻𝘄𝗲𝘇𝗶𝗴𝗵𝗲𝗶𝗱 𝘃𝗮𝗻 𝗮𝘂𝘁𝗼-𝗮𝗻𝘁𝗶𝗹𝗶𝗰𝗵𝗮𝗺𝗲𝗻
ME/CVS wordt verondersteld een variant van een auto-immuunmechanisme te zijn. Hoewel typische auto-immuunziekten (ziekten waarbij het immuunsysteem zich tegen het eigen lichaam keert) worden gekenmerkt door pathogene IgG’s (afweereiwitten), kunnen bij ME/CVS andere auto-immuunmechanismen betrokken zijn die de autonome controle van bloedvaten beïnvloeden. Auto-antilichamen tegen antinucleaire antilichamen (richten zich tegen de celkernen van lichaamseigen cellen), dubbelstrengig DNA, enkelstrengig DNA, anti-ganglioside (tegen zenuwcelcomponenten), endotheel- en neuronale cellen (bloedvat- en zenuwcellen), en fosfolipiden (vetmoleculen) zijn geïdentificeerd bij ME/CVS-patiënten. Deze auto-antilichamen richten zich voornamelijk op het autonome en centrale zenuwstelsel, wat dysautonomie en immuundysregulatie bij ME/CVS kan verklaren.
𝗔𝘂𝘁𝗼-𝗮𝗻𝘁𝗶𝗹𝗶𝗰𝗵𝗮𝗺𝗲𝗻 𝘁𝗲𝗴𝗲𝗻 𝗻𝗲𝘂𝗿𝗼𝘁𝗿𝗮𝗻𝘀𝗺𝗶𝘁𝘁𝗲𝗿𝗿𝗲𝗰𝗲𝗽𝘁𝗼𝗿𝗲𝗻
Bij sommige ME/CVS-patiënten zijn auto-antilichamen tegen neurotransmitterreceptoren (receptoren die signalen voor zenuwcommunicatie ontvangen) zoals muscarine M1AChR (acetylcholine-receptor), M3AChR (acetylcholine-receptor) en adrenerge B2AdR (receptoren voor adrenaline) gevonden. Deze auto-antilichamen kunnen receptorfuncties verstoren, hoewel er geen verschil is gevonden in auto-antilichamen tegen serotonine (neurotransmitter), angiotensine (hormoon), endotheline (bloedvatvernauwer), mu-opioïde (opioïdreceptor) en dopamine (neurotransmitter) tussen ME/CVS-patiënten en controles. Auto-antilichamen tegen serotonine worden echter wel in verband gebracht met ME/CVS.
𝗢𝗽𝗹𝗼𝘀𝗯𝗮𝗿𝗲 𝗮𝘂𝘁𝗼-𝗶𝗺𝗺𝘂𝗻𝗶𝘁𝗲𝗶𝘁𝘀𝗺𝗮𝗿𝗸𝗲𝗿𝘀
B-lymfocytactiverende factor (BAFF, een eiwit dat B-cellen stimuleert), die de overleving en rijping van B-cellen reguleert, is verhoogd bij sommige ME/CVS-patiënten, hoewel de genactiviteit van de BAFF-receptor verminderd is. Verhoogde niveaus van leden van de TGF-β-familie (groeifactoren die ontstekingen en weefselherstel beïnvloeden), activine A en B (eiwitten die ontsteking en spiergroei reguleren), zijn ook gevonden bij ME/CVS-patiënten. Hoewel geen oorzakelijk verband is vastgesteld, beïnvloeden activine A en IL-21 (interleukine 21, een ontstekingsmolecuul) de immuunregulatie (afweermechanismen) en kunnen ze betrokken zijn bij auto-immuun- en ontstekingsziekten.
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲
Auto-immuniteit speelt een belangrijke rol bij ME/CVS, gekenmerkt door genetische predisposities (erfelijke vatbaarheid) en de aanwezigheid van diverse auto-antilichamen. Hoewel verdere studies nodig zijn om de exacte mechanismen (onderliggende processen) te begrijpen, suggereren huidige bevindingen dat immuundysregulatie (verstoorde afweer) en auto-immuniteit bijdragen aan de symptomen en pathologie van ME/CVS.
𝗕𝗲𝗵𝗲𝗲𝗿 𝘃𝗮𝗻 𝗠𝗘/𝗖𝗩𝗦

𝗚𝗲𝗯𝗿𝗲𝗸 𝗮𝗮𝗻 𝗱𝗶𝗮𝗴𝗻𝗼𝘀𝘁𝗶𝘀𝗰𝗵𝗲 𝘁𝗲𝘀𝘁𝘀 𝗲𝗻 𝗲𝗳𝗳𝗲𝗰𝘁𝗶𝗲𝘃𝗲 𝘁𝗵𝗲𝗿𝗮𝗽𝗶𝗲𝗲̈𝗻
ME/CVS-patiënten hebben te maken met een tekort aan betrouwbare diagnostische tests en effectieve behandelingen. De complexiteit en diversiteit van symptomen, samen met het gebrek aan bewustzijn en begrip bij gezondheidswerkers, maken het uitdagend om een geschikte behandeling te vinden. Hierdoor ligt de focus momenteel op symptoombeheersing en levensstijlaanpassingen.
𝗨𝗶𝘁𝗱𝗮𝗴𝗶𝗻𝗴𝗲𝗻 𝗶𝗻 𝗱𝗶𝗮𝗴𝗻𝗼𝘀𝗲 𝗲𝗻 𝗯𝗲𝗵𝗮𝗻𝗱𝗲𝗹𝗶𝗻𝗴
1. Gebrek aan bewustzijn: Veel gezondheidswerkers zijn niet goed geïnformeerd over ME/CVS, wat leidt tot misdiagnose en inadequate zorg.
2. Heterogeniteit tussen patiënten: De symptomen en ernst van ME/CVS variëren sterk tussen patiënten, wat de ontwikkeling van een universele behandelingsaanpak bemoeilijkt.
3. Onvoorspelbare terugvallen: Patiënten kunnen onvoorspelbare opflakkeringen van symptomen ervaren, wat het moeilijk maakt om een stabiel behandelplan te handhaven.
4. Veelheid aan symptomen: ME/CVS omvat een breed scala aan symptomen, waardoor gerichte behandelingen lastig zijn.
𝗦𝘆𝗺𝗽𝘁𝗼𝗼𝗺𝗯𝗲𝗵𝗲𝗲𝗿𝘀𝗶𝗻𝗴 𝗲𝗻 𝗹𝗲𝘃𝗲𝗻𝘀𝘀𝘁𝗶𝗷𝗹𝗮𝗮𝗻𝗽𝗮𝘀𝘀𝗶𝗻𝗴𝗲𝗻
Omdat er geen genezende behandelingen beschikbaar zijn, richten de huidige strategieën zich op het beheersen van symptomen en het aanpassen van de levensstijl van patiënten. Enkele van de belangrijkste aanbevelingen zijn:
1. Energiebeheer: Patiënten worden aangemoedigd om hun energie zorgvuldig te beheren door activiteiten te plannen en rustpauzes in te lassen om overbelasting te voorkomen.
2. Slaapmanagement: Goede slaapgewoonten zijn cruciaal. Dit kan door het aanhouden van een regelmatig slaapschema, een rustgevende slaapomgeving, en mogelijk het gebruik van slaapmedicatie onder begeleiding van een arts.
3. Dieet en voeding: Een gebalanceerd dieet kan helpen bij het verbeteren van het algemene welzijn en energieniveaus. Sommige patiënten vinden baat bij het vermijden van bepaalde voedingsmiddelen die hun symptomen verergeren.
4. Stressmanagement: Technieken zoals mindfulness, meditatie, en yoga kunnen helpen bij het verminderen van stress, wat op zijn beurt kan helpen bij het beheersen van symptomen.
5. Lichaamsbeweging: Lichte, gecontroleerde fysieke activiteit kan nuttig zijn, maar het is belangrijk om niet te overdrijven en te luisteren naar het lichaam om terugvallen te voorkomen.
6. Medicatie: Hoewel er geen specifieke medicatie voor ME/CVS is, kunnen sommige medicijnen helpen bij het beheersen van symptomen zoals pijn, slaapstoornissen, en depressie.
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲
Hoewel ME/CVS een complexe en uitdagende aandoening is om te beheren, kunnen patiënten hun kwaliteit van leven verbeteren door een focus op symptoombeheersing en aanpassingen in hun levensstijl. Het gebrek aan effectieve diagnostische en therapeutische opties benadrukt de noodzaak voor verder onderzoek en bewustwording onder gezondheidswerkers.
𝗛𝗲𝘁 𝗼𝗻𝗴𝗲𝗹𝗼𝗼𝗳 𝘃𝗮𝗻 𝗮𝗿𝘁𝘀𝗲𝗻 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦

𝗚𝗲𝗯𝗿𝗲𝗸 𝗮𝗮𝗻 𝗸𝗲𝗻𝗻𝗶𝘀 𝗲𝗻 𝘀𝘁𝗶𝗴𝗺𝗮𝘁𝗶𝘀𝗲𝗿𝗶𝗻𝗴
ME/CVS blijft een complex en slecht begrepen syndroom, wat bijdraagt aan de moeilijkheid in het verkrijgen van een juiste diagnose en behandeling. In 1969 classificeerde de Wereldgezondheidsorganisatie (WHO) ME/CVS als een neurologische ziekte. Echter, de stigmatisering begon in 1970 toen psychiaters McEvedy en Beard ME/CVS beschreven als massahysterie. Deze stigmatisering bleef ondanks dat hun conclusies later werden verworpen.
𝗗𝗶𝗮𝗴𝗻𝗼𝘀𝘁𝗶𝘀𝗰𝗵𝗲 𝘃𝗲𝗿𝘁𝗿𝗮𝗴𝗶𝗻𝗴𝗲𝗻 𝗲𝗻 𝗼𝗻𝘇𝗲𝗸𝗲𝗿𝗵𝗲𝗶𝗱 𝘃𝗮𝗻 𝗮𝗿𝘁𝘀𝗲𝗻
Diagnostische vertragingen worden vaak veroorzaakt door de aarzeling van artsen om hun initiële diagnose te vertrouwen. Dit kan ertoe leiden dat patiënten zich verwaarloosd voelen en verdere doorverwijzingen naar andere professionals nodig hebben om andere mogelijke diagnoses uit te sluiten. Hoewel doorverwijzingen naar psychiaters soms nuttig zijn, kan dit ook leiden tot het labelen van patiënten als hypochonders en het toeschrijven van hun toestand aan psychosomatische oorzaken, wat schadelijk kan zijn.
𝗢𝗻𝗱𝗲𝗿𝘀𝘁𝗲𝘂𝗻𝗶𝗻𝗴 𝗲𝗻 𝘃𝗮𝗹𝗶𝗱𝗮𝘁𝗶𝗲
Het is cruciaal dat artsen de ervaringen van ME/CVS-patiënten valideren en hen ondersteunen. Familie en vrienden spelen ook een belangrijke rol door patiënten te helpen bij praktische zaken zoals het verkrijgen van invaliditeitsvoorzieningen en aanpassingen op werk en school. Regelmatige medische bezoeken zijn essentieel voor het monitoren van symptomen en het bespreken van nieuwe behandelmethoden, inclusief supplementen, om nadelige bijwerkingen en geneesmiddelinteracties te minimaliseren.
𝗢𝗽𝗲𝗻 𝗰𝗼𝗺𝗺𝘂𝗻𝗶𝗰𝗮𝘁𝗶𝗲 𝗲𝗻 𝗵𝘂𝗶𝘀𝗯𝗲𝘇𝗼𝗲𝗸𝗲𝗻
Open communicatie tussen artsen en patiënten over de prognose en de mogelijke effecten van behandelingen kan bijdragen aan een betere kwaliteit van leven voor ME/CVS-patiënten. Voor ernstig zieke patiënten die moeite hebben om medische bezoeken bij te wonen, zijn huisbezoeken een noodzakelijke aanpassing.
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲
Het ongeloof en de stigmatisering van ME/CVS door artsen belemmeren een tijdige diagnose en effectieve behandeling. Door het valideren van de ervaringen van patiënten, het bieden van steun en het bevorderen van open communicatie, kunnen de uitdagingen in de zorg voor ME/CVS-patiënten aanzienlijk verminderd worden.
𝗣𝗮𝗰𝗶𝗻𝗴 𝗲𝗻 𝗲𝗻𝗲𝗿𝗴𝗶𝗲𝗯𝗲𝗵𝗲𝗲𝗿 𝗯𝗶𝗷 𝗠𝗘/𝗖𝗩𝗦
𝗖𝗼𝗻𝘁𝗿𝗼𝘃𝗲𝗿𝘀𝗲 𝗿𝗼𝗻𝗱𝗼𝗺 𝗯𝗲𝗵𝗮𝗻𝗱𝗲𝗹𝗶𝗻𝗴𝗲𝗻
Verschillende richtlijnen zijn opgesteld om de behandeling van ME/CVS te begeleiden. Echter, sommige aanbevelingen, zoals graduele oefentherapie (GET), hebben mogelijk meer kwaad dan goed gedaan. GET, dat fysieke activiteit van een patiënt stapsgewijs verhoogt, werd sterk bekritiseerd vanwege de schade die het heeft veroorzaakt. In oktober 2021 werd GET verwijderd uit de NICE-richtlijnen. Het gebruik van cognitieve gedragstherapie (CGT) kan nuttig zijn voor symptomen of secundaire stoornissen zoals depressie, maar niet als remedie voor ME/CVS zelf.
𝗠𝗶𝘀𝗹𝗲𝗶𝗱𝗶𝗻𝗴 𝘃𝗮𝗻 𝗱𝗲 𝗣𝗔𝗖𝗘-𝘀𝘁𝘂𝗱𝗶𝗲
De PACE-studie uit 2011 beschreef GET en CGT als veilig en effectief, maar deze studie werd bekritiseerd vanwege methodologische tekortkomingen, zoals het wijzigen van uitkomstmaten halverwege het onderzoek en het classificeren van verslechterende patiënten als ‘hersteld’. Later onderzoek onthulde dat de verbeterings- en herstelpercentages niet significant verschilden van die van de controledeelnemers, en dat 54% tot 74% van de patiënten schade ondervond na GET.
𝗣𝗮𝗰𝗶𝗻𝗴 𝗮𝗹𝘀 𝗮𝗹𝘁𝗲𝗿𝗻𝗮𝘁𝗶𝗲𝗳
Tegenwoordig wordt de nadruk gelegd op energiemanagement, of pacing, voor symptoombeheersing. Pacing is een geïndividualiseerde aanpak waarbij patiënten hun energieverbruik monitoren om post-exertionele malaise (PEM) te verminderen. Dit omvat het beheren van fysieke, sociale, cognitieve en emotionele activiteiten. Door PEM te vermijden, kunnen vermoeidheid, cognitieve problemen, slaapverstoring en andere symptomen van ME/CVS worden verminderd. Hulpmiddelen zoals douchestoelen, hartslagmeters en de Visible-app helpen bij het monitoren en besparen van energie.
𝗡𝗜𝗖𝗘-𝗿𝗶𝗰𝗵𝘁𝗹𝗶𝗷𝗻𝗲𝗻 𝗲𝗻 𝗳𝘆𝘀𝗶𝗲𝗸𝗲 𝗮𝗰𝘁𝗶𝘃𝗶𝘁𝗲𝗶𝘁
Volgens de gewijzigde NICE-richtlijnen is een geïndividualiseerde aanpak het meest geschikt voor ME/CVS-patiënten. Als patiënten fysieke activiteit willen inbouwen, moet dit nauwlettend worden gevolgd door een team van specialisten, zoals fysiotherapeuten of ergotherapeuten, om overmatige inspanning en verergering van symptomen te voorkomen. Patiënten moeten hun activiteitenniveau meten en oppassen voor mogelijke terugvallen.
𝗡𝘂𝘁𝗿𝗮𝗰𝗲𝘂𝘁𝗶𝗰𝗮𝗹𝘀 𝗲𝗻 𝗳𝗮𝗿𝗺𝗮𝗰𝗼𝗹𝗼𝗴𝗶𝘀𝗰𝗵𝗲 𝗯𝗲𝗻𝗮𝗱𝗲𝗿𝗶𝗻𝗴𝗲𝗻
Veel ME/CVS-patiënten gebruiken voedingssupplementen, zoals vitamine D en bisfosfonaten (botafbraak-remmende medicijnen), om vitamine D-tekort en osteoporose te voorkomen. Supplementen zoals zink en magnesium kunnen nuttig zijn als blootstelling aan toxines een rol speelt bij de ontwikkeling van ME/CVS. Hoewel er geen door de FDA goedgekeurde behandelingen voor ME/CVS bestaan, kunnen symptomen en comorbiditeiten worden behandeld, maar medicatie moet in lage doseringen worden geïntroduceerd vanwege de gevoeligheid van ME/CVS-patiënten voor medicijnen. Antidepressiva worden soms voorgeschreven bij depressie.
𝗕𝗲𝗵𝗮𝗻𝗱𝗲𝗹𝗶𝗻𝗴 𝘃𝗮𝗻 𝗰𝗼𝗺𝗼𝗿𝗯𝗶𝗱𝗶𝘁𝗲𝗶𝘁𝗲𝗻
ME/CVS overlapt met verschillende auto-immuunziekten en immuungemedieerde ziekten (ziektes door immuunsysteemverstoring, vaak zonder directe aanval op eigen weefsels) zoals Hashimoto-thyreoïditis, fibromyalgie, mestcelactivatiestoornis, slaapapneu, prikkelbare darm syndroom (PDS), secundaire depressie of angst, Ehlers-Danlos-syndroom en posturaal orthostatisch tachycardiesyndroom (POTS). Meer onderzoek is nodig om ME/CVS te onderscheiden van andere ziekten die chronische vermoeidheid veroorzaken. Het behandelen van comorbiditeiten kan sommige symptomen verlichten en de levenskwaliteit verbeteren.
𝗧𝗼𝗲𝗸𝗼𝗺𝘀𝘁𝗶𝗴𝗲 𝘁𝗵𝗲𝗿𝗮𝗽𝗶𝗲𝗲̈𝗻
Hoewel er geen reproduceerbare resultaten zijn gevonden voor een specifieke behandeling van ME/CVS, lijken sommige behandelingen veelbelovend. Verdere onderzoeken naar mogelijke farmacologische interventies zijn nodig. Aangezien de ME/CVS-patiëntengroep heterogeen is, zal waarschijnlijk geen enkele behandeling voor alle patiënten geschikt zijn.

𝗧𝗼𝗲𝗸𝗼𝗺𝘀𝘁𝗶𝗴𝗲 𝗼𝗻𝗱𝗲𝗿𝘇𝗼𝗲𝗸𝘀𝗮𝗮𝗻𝗯𝗲𝘃𝗲𝗹𝗶𝗻𝗴𝗲𝗻 𝘃𝗼𝗼𝗿 𝗠𝗘/𝗖𝗩𝗦
Onderzoek naar ME/CVS staat voor vele uitdagingen door inconsistente resultaten en variabele onderzoeksparameters, wat vergelijking en combinatie van resultaten bemoeilijkt. Problemen zoals ontoereikende steekproefomvang, korte follow-uptijden, hoge uitvalpercentages, en ongepaste definitie van herstel bemoeilijken het onderzoek. Om de reproduceerbaarheid te verbeteren, moeten onderzoeken uniforme criteria, gestandaardiseerde monsterverzameling, en grondige statistische analyses gebruiken.

𝗚𝗲𝗯𝗿𝗲𝗸 𝗮𝗮𝗻 𝗳𝗶𝗻𝗮𝗻𝗰𝗶𝗲𝗿𝗶𝗻𝗴
Ondanks een toename in onderzoek naar ME/CVS de afgelopen tien jaar, blijft de financiering ontoereikend. In 2019 had de NIH slechts 15 miljoen dollar begroot voor ME/CVS-onderzoek, terwijl veel meer werd gedoneerd aan onderzoek naar multiple sclerose (MS) en reumatoïde artritis (RA). Ziektes waarvoor al medicijnen bestaan. Er is dringend meer financiering nodig om ME/CVS beter te definiëren, diagnostische methoden te verbeteren, en onderzoek naar effectieve behandelingen te bevorderen.
𝗩𝗲𝗿𝗯𝗲𝘁𝗲𝗿𝗶𝗻𝗴 𝘃𝗮𝗻 𝗼𝗻𝗱𝗲𝗿𝘇𝗼𝗲𝗸𝘀𝗺𝗲𝘁𝗵𝗼𝗱𝗲𝗻
- Uniforme diagnostische criteria: Om robuuste en reproduceerbare resultaten te verkrijgen, moeten standaardisatie in diagnose en ernst van de ziekte worden toegepast.
- Vergelijkingsgroepen: Onderzoek moet goed op elkaar afgestemde controles gebruiken, rekening houdend met factoren zoals leeftijd, levensstijl, medicatie, geografie, en dieet.
- Grootschalige genetische studies: Grote genome-wide association studies (GWAS), zoals het DecodeME-onderzoek, zijn nodig om de biomoleculaire mechanismen van ME/CVS te begrijpen.
𝗕𝗲𝘁𝗿𝗲𝗸𝗸𝗲𝗻 𝘃𝗮𝗻 𝗲𝗿𝗻𝘀𝘁𝗶𝗴 𝘇𝗶𝗲𝗸𝗲 𝗽𝗮𝘁𝗶𝗲̈𝗻𝘁𝗲𝗻
Veel ME/CVS-patiënten zijn huis- of bedgebonden en kunnen niet deelnemen aan herhaalde kliniekbezoeken. Onderzoek moet meer toegankelijk worden gemaakt voor deze groep, aangezien zij zwaar getroffen worden en mogelijk belangrijke biomarkers bezitten die cruciaal zijn voor het begrip van de ziekte.
𝗢𝗻𝗱𝗲𝗿𝘇𝗼𝗲𝗸 𝗻𝗮𝗮𝗿 𝗽𝗼𝘀𝘁𝗶𝗻𝗳𝗲𝗰𝘁𝗶𝗲𝘂𝘇𝗲 𝗺𝗲𝗰𝗵𝗮𝗻𝗶𝘀𝗺𝗲𝗻
De COVID-19-pandemie kan het aantal ME/CVS-gevallen doen toenemen, vooral gezien de overlap met symptomen van Long Covid. Onderzoek moet bepalen of deze symptomen voortkomen uit orgaanschade of postinfectieuze immuunstoornissen, vergelijkbaar met de pathomechanismen van ME/CVS.
𝗗𝗼𝗼𝗿𝗯𝗿𝗲𝗸𝗲𝗻 𝘃𝗮𝗻 𝘀𝘁𝗶𝗴𝗺𝗮
ME/CVS-patiënten ervaren vaak ongeloof en vooroordelen van zorgverleners. Het is essentieel om deze negatieve percepties te doorbreken en erkenning te geven aan ME/CVS als een ernstige chronische ziekte. Zorgverleners moeten empathische relaties opbouwen en de validiteit van de symptomen van hun patiënten erkennen.
𝗢𝗻𝗱𝗲𝗿𝘀𝘁𝗲𝘂𝗻𝗶𝗻𝗴 𝘃𝗮𝗻 𝗱𝗲 𝗠𝗘/𝗖𝗩𝗦 𝗴𝗲𝗺𝗲𝗲𝗻𝘀𝗰𝗵𝗮𝗽
Initiatieven zoals het Europese Netwerk voor ME/CVS (EUROMENE) en de Open Medicine Foundation bevorderen onderzoek, bewustzijn en steun voor ME/CVS-patiënten. Organisaties zoals WE&ME en Action for ME zamelen fondsen in en bevorderen voorlichting en steun voor patiënten en hun families.
𝗖𝗼𝗻𝗰𝗹𝘂𝘀𝗶𝗲
Toekomstig onderzoek naar ME/CVS moet zich richten op standaardisatie van diagnostische criteria, grotere genetische studies, toegankelijkheid voor ernstig zieke patiënten, en begrip van postinfectieuze mechanismen. Daarnaast is het cruciaal om het stigma rond ME/CVS te doorbreken en meer ondersteuning te bieden aan de gemeenschap. Met deze stappen kunnen we vooruitgang boeken in het begrip en de behandeling van ME/CVS.
© Arron et al., 2024. Vertaling Millions Missing Holland








