Scott LaFee, UC San Diego Health, 27 april 2020
Nieuw onderzoek toont een verband aan tussen een vaak voorkomende blootstelling aan humaan herpesvirus-6, dat een DNA-kopie van het virus achterlaat, en veel van de symptomen van een invaliderende ziekte, myalgische encefalomyelitis/chronisch vermoeidheidssyndroom.
Myalgische encefalomyelitis/ chronisch vermoeidheidssyndroom (ME/cvs) is een invaliderende en complexe ziekte. Getroffen personen kunnen vaak geen gewone activiteiten uitoefenen – fysiek noch mentaal – omwille van een invaliderend verlies van energie en andere symptomen, en kunnen jarenlang aan bed of huis gebonden zijn.
Iedereen kan ME/cvs ontwikkelen, hoewel het meestal mensen tussen de 40 en 60 jaar treft; vrouwen vaker dan mannen. In bijna alle gevallen begint ME/cvs na een reeks van ernstige milieublootstellingen, letsels of infecties. Tot voor kort overtuigde het volslagen mysterie en de complexiteit van ME/cvs sommigen dat het geen “echte” aandoening was. In 2015 verklaarde de National Academy of Medicine dat ME/cvs een ernstige, chronische en complexe systeemziekte was.
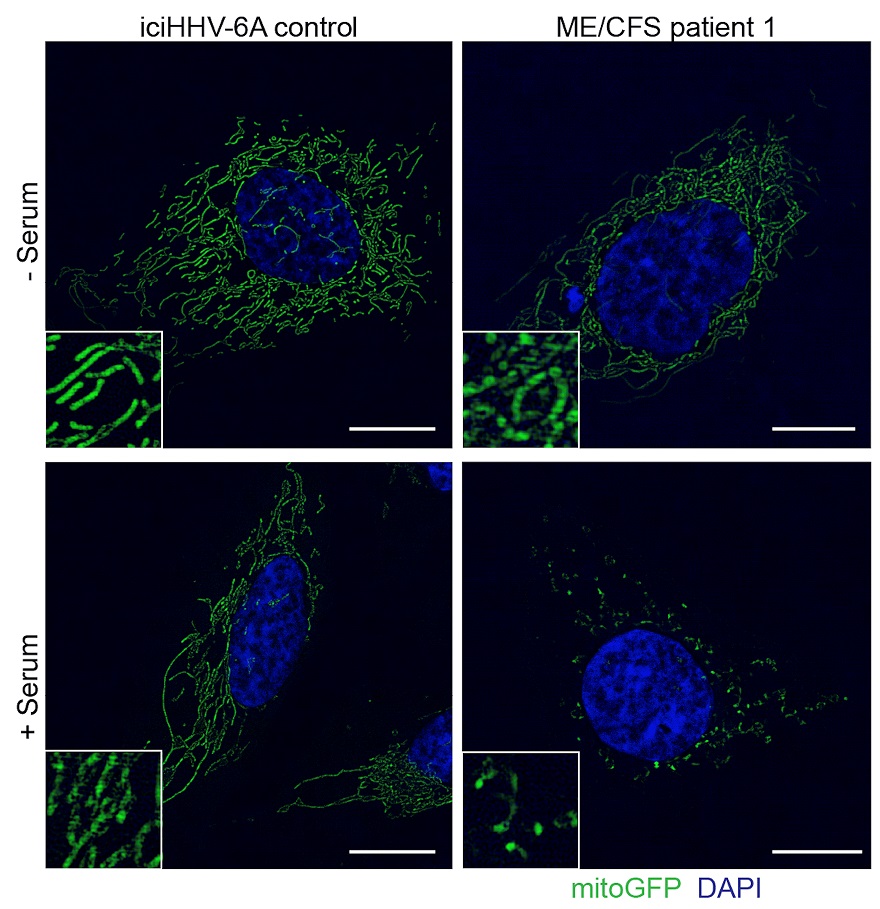
Gecultuurde cellen met een latente kopie van HHV-6-DNA voor en na behandeling met serum. A en B: groene mitochondriale netwerken zijn normaal gesproken filamenteus. Na behandeling met gezond serum van controles, blijven de mitochondriën langwerpig. D: na behandeling met serum van ME/cvs-patiënten, zijn mitochondriën gefragmenteerd en was de ATP-productie verlaagd.
In een nieuwe studie, die op 1 mei 2020 gepubliceerd wordt in de gedrukte editie van ImmunoHorizons, beschrijft een team van onderzoekers aan de San Diego School of Medicine van University of California en drie Duitse universiteiten een onderliggende biologische basis voor ME/cvs, één die illustreert hoe de inspanningen van het lichaam om de bescherming van het immuunsysteem te versterken, ten koste gaan van fysiologische problemen elders.
“Deze bevindingen zijn belangrijk omdat ze voor de eerste keer aantonen dat er een antivirale activiteit is in het serum van patiënten met ME/cvs, die nauw verband houdt met een activiteit die het mitochondriaal netwerk fragmenteert en de cellulaire energieproductie (ATP) verlaagt,” zei Dr. Robert Naviaux, PhD, professor geneeskunde, pediatrie en pathologie aan UC San Diego School of Medicine.
Naviaux is co-seniorauteur van de studie met Bhupesh K. Prusty, PhD, een wetenschapper aan het Departement Microbiologie en Instituut voor Virologie en Immunobiologie aan de Julius Maximilians University in het Duitse Würzburg.
“Dit verklaart de algemene waarneming dat ME/cvs-patiënten vaak een scherpe afname melden in het aantal verkoudheden en virale infecties die ze ervaren nadat ze de ziekte ontwikkelden. Ons werk helpt ook bij het begrijpen van het lang gekende, maar slecht begrepen verband tussen ME/cvs en eerdere infecties met humaan herpesvirus-6 (HHV-6) of HHV-7.”
Meer dan 90% van mensen worden blootgesteld aan HHV-6 tegen de leeftijd van drie jaar. Het virus-DNA kan zichzelf inbrengen in een chromosoom en blijft jarenlang latent aanwezig in slechts een paar cellen, en wordt in stilte gekopieerd elke keer dat de cel zich deelt. Voor de meeste mensen veroorzaakt dit geen probleem.
“We ontdekten echter dat blootstelling aan nieuwe metabole of omgevingschemische stressoren ervoor zorgden dat cellen met een geïntegreerde kopie van HHV-6 een activeringsstofje afscheidden die naburige cellen voor de dreiging waarschuwde,” zei Naviaux. “Het afgescheiden activeringsstofje beschermde niet alleen naburige en verder gelegen cellen van nieuwe RNA- en DNA-virusinfecties, maar fragmenteerde ook het mitochondriaal netwerk en verlaagde hun intracellulaire ATP-reservecapaciteit. Cellen zonder een geïntegreerde kopie van HHV-6 scheidden geen antivirale activeringsstofjes af.
“Onze resultaten tonen dat cellulaire bio-energetische vermoeidheid en cellulaire afweer twee kanten zijn van dezelfde medaille bij ME/cvs. Als energie gebruikt wordt voor cellulaire afweer, is het niet beschikbaar voor normale celfuncties zoals groei, herstel, en functies van het neuro-endocriene en autonome zenuwstelsel.”
Elektronenmicrograaf van partikels humaan herpesvirus-6 die ontluiken uit een cel.
De bevindingen belichten verder een concept dat de celgevaarreactietheorie wordt genoemd, die Naviaux en collega’s al jaren aan het onderzoeken zijn. De CGR-theorie stelt dat chronische ziekte het gevolg is van de natuurlijke genezingscyclus die geblokkeerd wordt door verstoringen op de metabole en cellulaire niveaus. In dit geval kregen personen met ME/cvs bescherming tegen bepaalde infecties, maar ten koste van gefragmenteerde mitochondriale functie. Persistentie van gefragmenteerde mitochondriën en de bijhorende afwijkingen in celsignalering blokkeert normale genezing en herstel, en kan leiden tot een levenslange ziekte.
Mitochondriën zijn organellen in cellen die nutriënten afbreken om een brandstof te creëren die adenosinetrifosfaat (ATP) genoemd wordt; de primaire energiedrager in alle levende organismen. ATP levert de energie die gebruikt wordt om vele cellulaire processen aan te drijven, waaronder spiercontracties, zenuwimpulsen en chemische synthese.
“Deze paper zal een paradigmaverschuiving zijn in ons begrip over potentiële infectieuze oorzaken achter ME/cvs. Van humaan herpesvirus-6 en HHV-7 werd lang gedacht dat ze een rol spelen in deze ziekte, maar er was tot hier toe nauwelijks een oorzakelijk mechanisme bekend,” zei senior coauteur Prusty.
“Voor de eerste keer tonen we aan dat zelfs maar een paar met HHV-6 geïnfecteerde of gereactiveerde cellen een krachtige metabole en mitochondriale hermodelleringsreactie kunnen aandrijven die zelfs de cellen die geen virus bevatten in een hypometabole (abnormaal lage metabole) staat kan duwen. Hypometabole cellen zijn resistent tegen andere virale infecties en veel omgevingsstressoren, maar dit gaat gepaard met ernstige symptomen en lijden voor patiënten met ME/cvs.”
Coauteurs zijn onder meer Philipp Schreiner, Stephanie Lamer en Andreas Schlosser, Julius-Maximilians-Universität Würzburg; Thomas Harrer, Friedrich-Alexander-Universität Erlangen-Nürnberg; en Carmen Scheibenbogen, Charité-Universitätsmedizin Berlin.
Financiering voor dit onderzoek kwam deels van het Solve ME/CFS Initiative, de HHV-6 Foundation, het UCSD Christini Fund, de Lennox Foundation, het JMS Fund, de Khosla Foundation, de Westreich Foundation and de Malone Foundation.
Volledige studie: https://www.immunohorizons.org/content/4/4/201
Media contact: Scott LaFee, 858-249-0456, slafee@health.ucsd.edu
© UC San Diego Health. Vertaling Zuiderzon, redactie Abby, ME-gids.
 Human Herpesvirus-6 Reactivation, Mitochondrial Fragmentation, and the Coordination of Antiviral and Metabolic Phenotypes in Myalgic Encephalomyelitis/Chronic Fatigue Syndrome
Human Herpesvirus-6 Reactivation, Mitochondrial Fragmentation, and the Coordination of Antiviral and Metabolic Phenotypes in Myalgic Encephalomyelitis/Chronic Fatigue Syndrome
Philipp Schreiner, Thomas Harrer, Carmen Scheibenbogen, Stephanie Lamer, Andreas Schlosser, Robert K. Naviaux and Bhupesh K. Prusty
ImmunoHorizons April 1, 2020, 4 (4) 201-215; DOI: https://doi.org/10.4049/immunohorizons.2000006
Abstract
Myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS) is a multifactorial disorder with many possible triggers. Human herpesvirus (HHV)–6 and HHV-7 are two infectious triggers for which evidence has been growing. To understand possible causative role of HHV-6 in ME/CFS, metabolic and antiviral phenotypes of U2-OS cells were studied with and without chromosomally integrated HHV-6 and with or without virus reactivation using the histone deacetylase inhibitor trichostatin-A. Proteomic analysis was conducted by pulsed stable isotope labeling by amino acids in cell culture analysis. Antiviral properties that were induced by HHV-6 transactivation were studied in virus-naive A549 cells challenged by infection with influenza-A (H1N1) or HSV-1. Mitochondria were fragmented and 1-carbon metabolism, dUTPase, and thymidylate synthase were strongly induced by HHV-6 reactivation, whereas superoxide dismutase 2 and proteins required for mitochondrial oxidation of fatty acid, amino acid, and glucose metabolism, including pyruvate dehydrogenase, were strongly inhibited. Adoptive transfer of U2-OS cell supernatants after reactivation of HHV-6A led to an antiviral state in A549 cells that prevented superinfection with influenza-A and HSV-1. Adoptive transfer of serum from 10 patients with ME/CFS produced a similar fragmentation of mitochondria and the associated antiviral state in the A549 cell assay. In conclusion, HHV-6 reactivation in ME/CFS patients activates a multisystem, proinflammatory, cell danger response that protects against certain RNA and DNA virus infections but comes at the cost of mitochondrial fragmentation and severely compromised energy metabolism.
Citeren?
Schreiner, P., Harrer, T., Scheibenbogen, C., Lamer, S., Schlosser, A., Naviaux, R.K., en Prusty, B.K., 2020. Human Herpesvirus-6 Reactivation, Mitochondrial Fragmentation, and the Coordination of Antiviral and Metabolic Phenotypes in Myalgic Encephalomyelitis/Chronic Fatigue Syndrome. ImmunoHorizons 4 (4) 201-215; DOI: https://doi.org/10.4049/immunohorizons.2000006





