Kavli Fondet, 22 december 2016
Een nieuwe studie, die meegefinancierd werd door de Kavli Stichting, stelt dat het PDH-enzym geremd wordt bij ME/cvs-patiënten, wat zowel het energietekort als de verhoogde melkzuurproductie bij deze patiënten kan verklaren. Deze bevindingen werden in het Journal of Clinical Investigation Insight gepubliceerd.
Door Øystein Fluge, Karl Johan Tronstad en Olav Mella

Foto: Øystein Fluge, senior consultant en kankerwetenschapper, en Karl Johan Tronstad, professor
De Kavli Stichting steunt sinds 2011 het onderzoek naar ME aan de afdeling oncologie aan het Universitair Ziekenhuis Haukeland. De samenwerking met de Kavli Stichting stelde de groep in staat om zich voor nieuwe projecten te engageren en wetenschappelijke vooruitgang te boeken op het gebied van biomedisch onderzoek naar ME/CVS.

Foto: Olav Mella, afdelingshoofd en professor en Kari Sørland, nationaal projectcoördinator en verpleegster
Indertijd heeft de onderzoeksgroep klinische studies gepubliceerd, die het gebruik van het immuungeneesmiddel Rituximab onderzochten bij patiënten met ME/CVS ([i], [ii], [iii]). Rituximab is een kunstmatig vervaardigd antilichaam, dat het aantal B-lymfocyten vermindert, een type witte bloedcellen dat zich kan ontwikkelen tot immuuncellen met een aantal functies, waaronder antilichaamproducerende cellen. Deze studies toonden een verbetering van symptomen aan bij ongeveer 60% van de met het geneesmiddel behandelde patiënten. We stellen de hypothese dat ME in een subgroep van patiënten een soort immuunziekte zou kunnen zijn, waarin B-cellen en mogelijke schadelijke effecten van antistoffen een rol spelen.
Bevestigen of weerleggen
Vijf Noorse ziekenhuizen werken nu samen aan een klinische studie, die moet bevestigen of weerleggen of Rituximab nuttig kan zijn in de behandeling van ME-patiënten. De onderzoeksgroep aan Haukeland voert ook een trial uit met matige doses van het chemotherapeutisch middel Cyclofosfamide, dat immuunonderdrukkende effecten heeft en zich op meer delen van het immuunsysteem richt dan het meer specifieke Rituximab. Door deze klinische studies kunnen we mogelijke behandelmethoden ontdekken en tegelijkertijd de onderliggende symptoommechanismen in ME aan het licht brengen.
Biochemische veranderingen
Meer dan 200 patiënten werden in onze studie opgenomen na grondige medische beoordeling volgens de internationaal geaccepteerde («Canadese») criteria. Deze patiënten worden systematisch en gestandaardiseerd opgevolgd in de studies en geven geregeld bloedstalen aan een biobank voor onderzoek. Op basis van het verzamelde materiaal in de biobank bracht de onderzoeksgroep het metabolisme van 200 patiënten en 100 gezonde controles uitgebreid en gedetailleerd in kaart. Het project werd begeleid door de auteurs (Karl Johan Tronstad, Øystein Fluge en Olav Mella), en uitgevoerd in samenwerking met Bevital AS en Per M. Ueland.
Aan de hand van deze metabolische analyses hebben we specifieke biochemische veranderingen gedetecteerd in het bloed van ME/CVS-patiënten. Deze bevindingen zijn nu in het Journal of Clinical Investigation Insight gepubliceerd.
De analyses van bloedstalen van ME/CVS-patiënten toonden aan dat de gehaltes van bepaalde aminozuren verminderd waren in vergelijking met gezonde controlepersonen. Het patroon van veranderingen in aminozuren gaf ons belangrijke informatie over de symptoommechanismen, en in het bijzonder over het energiemetabolisme van patiënten.
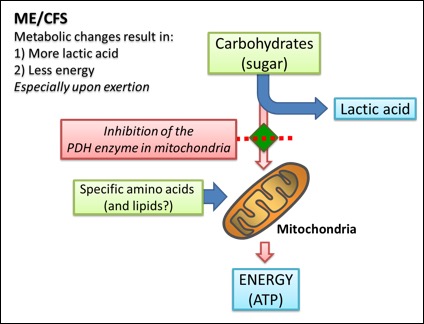
Kan energietekort verklaren
In normale omstandigheden gebruiken menselijke cellen koolhydraten, vetten (lipiden) en eiwitten (aminozuren) als bron van energie via katabole processen in de mitochondriën, de “energiecentrales” van de cel. Bij intensieve fysieke inspanning is er echter een tekort aan zuurstof dat aan de mitochondriën in de spieren geleverd wordt (anaerobe inspanning), waarbij glucose omgezet wordt in melkzuur. Aangezien lactaat zich ophoopt en er minder energieopbrengst is, zal het lichaam na een korte tijd “stop” zeggen. Het enzym pyruvaat dehydrogenase (PDH) speelt een belangrijke rol in de regeling van deze processen, aangezien het bijdraagt aan het coördineren van het gebruik van koolhydraten, aminozuren, en lipiden (vetten) als energiebronnen. De nieuwe studie suggereert dat het PDH-enzym geremd wordt in ME/CVS-patiënten, wat zowel het energietekort als de verhoogde lactaatproductie in deze patiënten kan verklaren.
Disfunctie van het PDH-enzym
Eerdere internationale studies rapporteerden verlaagde gehaltes van bepaalde aminozuren in het bloed van ME-patiënten. In onze nieuwe studie werden 20 standaardaminozuren geanalyseerd in het bloed van 200 patiënten, die opgenomen zijn in klinische studies, evenals 100 gezonde proefpersonen.
Er werd een specifieke vermindering in aminozuren, die onafhankelijk gekataboliseerd zijn van het PDH-enzym, waargenomen. Deze bevinding suggereert dat het PDH-enzym niet functioneert zoals het moet in ME-patiënten, en bijgevolg verhogen de cellen de consumptie van bepaalde aminozuren als brandstof in plaats van glucose.
De daling van bepaalde specifieke aminozuren die in energie omzetten, werd voornamelijk bij vrouwen met ME gevonden. In mannelijke ME-patiënten waren de verschillen in aminozuurgehaltes minder significant in vergelijking met gezonde mannen. We vonden echter verhoogde gehaltes van een bepaald aminozuur, dat de afbraak van eiwitten in spierweefsel in mannelijke ME-patiënten weerspiegelt. Aangezien mannen over het algemeen een grotere spiermassa dan vrouwen hebben, kunnen eiwitten uit spierweefsel functioneren als een extra energiereserve en zo de beschikbaarheid van aminozuren als een energiebron verhogen.
Onvoldoende energie
Het PDH-enzym is een sleutelcomponent in een van de belangrijkste reactiepaden voor de omzetting van koolhydraten in energie – een proces dat in de mitochondriën plaatsvindt. Als de activiteit van het PDH-enzym verzwakt is, kunnen de cellen reageren door de consumptie van alternatieve brandstoffen te verhogen, wat de veranderingen kan verklaren die gezien worden in het aminozuurprofiel in het bloed van ME-patiënten. Ondanks de pogingen van het lichaam om te compenseren, zou deze toestand het vermogen van de cellen om de metabolische processen aan te passen aan de veranderende vraag van energieproductie, comprommiteren. Fysieke activiteit bijvoorbeeld zou kunnen resulteren in een plots energietekort in de spieren, gekoppeld aan een ophoping van lactaat. Dit zijn normale effecten, die gezien worden bij gezonde mensen tijdens zware inspanning, maar ernstig zieke ME-patiënten kunnen deze symptomen vertonen na minimale belasting zoals uit bed komen en een paar stappen zetten. Feedback van patiënten in de studie wijst erop dat ze deze bevindingen in verband kunnen brengen met hun symptomen, waaronder een fundamenteel gebrek aan energie, malaise en pijn door melkzuur na fysieke activiteit.
Wanneer we overgingen tot het meten van de genexpressie (mRNA) in witte bloedcellen voor een aantal factoren die het PDH-enzym reguleren, vonden we dat verschillende belangrijke factoren die de PDH-functie hinderen, verhoogd waren in ME-patiënten. Interessant is dat deze veranderingen in genexpressie aanwezig waren bij zowel mannelijke als vrouwelijke ME-patiënten. Deze bevindingen wijzen er dus op dat remming van PDH zelf identiek is bij zowel mannen als vrouwen, maar de effecten op het metabolisme kunnen deels geslachtsafhankelijk zijn.
Verdere studies
Naar alle waarschijnlijkheid omvat ME ook regulerende problemen in andere delen van het metabolisme, bv. in het verwerken van lipiden (vetten). Dit is momenteel het onderwerp van verdere studies. Op basis van de resultaten van de studie naar het metabolisme, stellen we de hypothese dat ME-patiënten aan een remming van het PDH-enzym lijden, wat zowel een verminderd vermogen met zich meebrengt om energie te produceren uit koolhydraten, als een overmatige productie van lactaat in de spieren, zelfs na minimale inspanning. Een belangrijk aandachtspunt voor het huidige onderzoek is om beter te begrijpen hoe een vermoedelijk gebrekkige immuunrespons na een infectie zo’n remming van het cellulair metabolisme zou kunnen rechtvaardigen.
We theoretiseren dat de bestudeerde immuungeneesmiddelen (Rituximab en Cyclofosfamide) het foute signaal van het immuunsysteem op zo’n manier beïnvloeden dat de remming van het PDH-enzym vermindert. De normale afbraak van glucose kan dus hersteld worden en de productie van de «energie-eenheid» van het lichaam, ATP, kan zich beter aanpassen aan het activiteitenniveau van de patiënt.
We geloven dat de bevindingen in de studie belangrijk zijn voor het begrijpen van ME/CVS als een ziekte, en in overeenstemming zijn met twee recent gepubliceerde rapporten over metabole veranderingen in ME/CVS. De verwachte gevolgen van de waargenomen metabole veranderingen zijn compatibel met het klinisch beeld dat ME-patiënten vertonen.
 [i] http://bmcneurol.biomedcentral.com/articles/10.1186/1471-2377-9-28
[i] http://bmcneurol.biomedcentral.com/articles/10.1186/1471-2377-9-28
[ii] http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0026358
[iii] http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0129898
© Kavli Fondet. Vertaling Zuiderzon, redactie NAHdine, ME-gids.
Metabolic profiling indicates impaired pyruvate dehydrogenase function in myalgic encephalopathy/chronic fatigue syndrome
Øystein Fluge, Olav Mella, Ove Bruland, Kristin Risa, Sissel E. Dyrstad, Kine Alme, Ingrid G. Rekeland, Dipak Sapkota, Gro V. Røsland, Alexander Fosså, Irini Ktoridou-Valen, Sigrid Lunde,1Kari Sørland, Katarina Lien, Ingrid Herder, Hanne Thürmer, Merete E. Gotaas, Katarzyna A. Baranowska, Louis M.L.J. Bohnen, Christoph Schäfer, Adrian McCann, Kristian Sommerfelt,Lars Helgeland, Per M. Ueland, Olav Dahl, and Karl J. Tronstad
First published December 22, 2016 | Received: July 5, 2016 | Accepted: November 15, 2016
JCI Insight. 2017;1(21):e89376. doi:10.1172/jci.insight.89376.
Abstract
Myalgic encephalopathy/chronic fatigue syndrome (ME/CFS) is a debilitating disease of unknown etiology, with hallmark symptoms including postexertional malaise and poor recovery. Metabolic dysfunction is a plausible contributing factor. We hypothesized that changes in serum amino acids may disclose specific defects in energy metabolism in ME/CFS. Analysis in 200 ME/CFS patients and 102 healthy individuals showed a specific reduction of amino acids that fuel oxidative metabolism via the TCA cycle, mainly in female ME/CFS patients. Serum 3-methylhistidine, a marker of endogenous protein catabolism, was significantly increased in male patients. The amino acid pattern suggested functional impairment of pyruvate dehydrogenase (PDH), supported by increased mRNA expression of the inhibitory PDH kinases 1, 2, and 4; sirtuin 4; and PPARδ in peripheral blood mononuclear cells from both sexes. Myoblasts grown in presence of serum from patients with severe ME/CFS showed metabolic adaptations, including increased mitochondrial respiration and excessive lactate secretion. The amino acid changes could not be explained by symptom severity, disease duration, age, BMI, or physical activity level among patients. These findings are in agreement with the clinical disease presentation of ME/CFS, with inadequate ATP generation by oxidative phosphorylation and excessive lactate generation upon exertion.
Nieuwe Noorse studie naar de pathologische mechanismen van ME
Nieuwe Noorse ME/cvs studie naar de pathologische mechanismen (2017)
https://www.youtube.com/watch?v=HQkuFLf4bs8
Lees ook
- De verklaring voor de fysieke beperking bij patiënten met ME/CVS (CVS/ME Medisch Centrum)
- Interview met Dr. Øystein Fluge over zijn laatste onderzoek over ME/cvs, en het verhaal van Bjørnar.





