
Er is een overvloed aan studies die biologische veranderingen aantonen die gerelateerd zijn aan ME/cvs, maar een diagnostische biomarker moet nog worden vastgesteld. Diagnostische biomarkers zijn meetbare aanwijzingen in het lichaam die informatie geven over de aanwezigheid of progressie van een ziekte.
Omdat op dit moment de diagnose ME/cvs grotendeels gebaseerd is op zelfrapportagemetingen en de uitsluiting van andere aandoeningen, worden veel mensen met ME/cvs geconfronteerd met een gebrek aan validatie en wrijving bij de toegang tot gezondheidszorg en sociale diensten als gevolg van scepsis. Daarom is het vinden van een diagnostische biomarker zo belangrijk omdat dit onbetwistbaar ‘laboratoriumbewijs’ levert dat gaat helpen om het scepticisme over de ziekte weg te nemen en zal helpen bij een snellere diagnose voor iemand die bij de huisarts komt.
Daarom is de nieuwste bijdrage van dr. Karl Morten en collega’s aan deze gezamenlijke inspanning zeer welkom. De onderzoeksgroep combineerde ramanspectroscopie – een analytisch hulpmiddel dat gebruik maakt van licht – en artificiële intelligentie (AI) om de witte bloedcellen van mensen met ME/cvs te bestuderen in vergelijking met mensen met multiple sclerose (MS) en gezonde controles. De hoofdauteur van deze paper was Dr. Jiabao Xu, specialist op het gebied van ramanspectroscopie.
Met behulp van deze technieken waren de onderzoekers in staat om met hoge nauwkeurigheid (91%) onderscheid te maken tussen gezonde controles, personen met MS en personen met ME/cvs, en verder onderscheid te maken (met een nauwkeurigheid van 84%) tussen milde, matige en ernstige ME/cvs. Deze bevindingen zijn inderdaad veelbelovend. Het is echter belangrijk op te merken dat het een kleine studie was die op grotere schaal en onder gevarieerde omstandigheden herhaald moet worden om de bevindingen te valideren.
Een diepere kijk
Wat deed de studie?
Morten en collega’s begonnen met het ontwikkelen van een diagnostische methode om ME/cvs te onderscheiden van gezonde controles en andere ziekten die vermoeidheid veroorzaken, zoals MS.
Perifere mononucleaire bloedcellen (PBMC’s) – een subgroep van witte bloedcellen – werden verkregen uit de UK ME/CFS Biobank, waar ingevroren bloedmonsters worden bewaard van personen met ME/cvs (die voldoen aan de Canadese Consensus Criteria en/of Fukuda-criteria), en van personen met MS, naast gezonde controles. De studie omvatte in totaal 98 monsters: 61 ME/cvs, 21 MS en 16 gezonde controles. Met behulp van hun klinische profielen werd het ME/cvs-cohort verder onderverdeeld op basis van de ernst van de symptomen (mild, matig of ernstig). De impliciete reden voor het opnemen van personen met MS in deze studie was dat hun klinische symptomen aanzienlijk overlappen met die van mensen met ME/cvs, daarom zou het nuttig zijn om te weten of het mogelijk is om deze aandoeningen te onderscheiden met behulp van laboratoriummateriaal.
De onderzoekers probeerden aanvankelijk de celademhaling (het proces waarbij cellen energie opwekken) te beoordelen in PBMC’s van 41 van de 98 individuen, maar deze aanpak maakte geen effectief onderscheid tussen de ziektecohorten. Ze gooiden het over een andere boeg en gebruikten ramanspectroscopie, een techniek waarmee de moleculaire en chemische samenstelling van cellen kan worden geanalyseerd door de verstrooiing van laserlicht te meten en dit om te zetten in ramanspectra (grafieken). Hoewel er slechts 98 proefpersonen waren, werd er een enorme hoeveelheid gegevens (meer dan 2000 ramanspectra) geproduceerd van hun PBMC’s.
De ramandata werden vervolgens geanalyseerd met behulp van lineaire discriminantanalyse (LDA). Eenvoudig gezegd is LDA een classificatiemodel – een slim hulpmiddel dat items helpt sorteren in verschillende groepen/categorieën op basis van hun kenmerken. Het was dus de bedoeling dat het getraind kon worden om onderscheid te maken tussen ME/cvs-patiënten, MS-patiënten en gezonde controles door patronen en kenmerken te identificeren in de moleculaire/chemische profielen die verkregen werden met ramanspectroscopie. De onderzoekers zetten een testdataset opzij waarvan ze de diagnoses al kenden, zodat ze konden beoordelen of het LDA-model correct was getraind om de ramangegevens te onderscheiden op basis van diagnoses.
Daarnaast werd LDA gebruikt om de belangrijkste pieken in de ramanspectra te identificeren die verband hielden met bepaalde belangrijke moleculen, voornamelijk aminozuren – tryptofaan, tyrosine en fenylalanine. Al deze moleculen zijn eerder in verband gebracht met theorieën over de ontwikkeling van ME/cvs, waaronder in een pilootstudie van het team waarin fenylalanine werd voorgesteld als een potentiële biomarker.
LDA is slechts één type classificatiemodel. De onderzoekers gebruikten zeven andere classificatiemodellen en combineerden de outputs om een krachtiger model te creëren. Deze techniek staat bekend als ensemble machine learning, wat in wezen artificiële intelligentie is die rekening houdt met de voorspellingen van individuele modellen om een nauwkeurigere voorspelling te maken. Daarom kunnen ramangegevens van een bloedmonster van een individu worden ingevoerd in een ensemble ‘machine’ die theoretisch in staat zou moeten zijn om een diagnose te stellen op basis van alle trainingsgegevens.
Wat hebben ze gevonden?
Bevindingen uit de eerste analyse van ramangegevens
Met alleen LDA waren de onderzoekers in staat om de gegevens van de ramanspectroscopie te differentiëren in afzonderlijke groepen die elk van de cohorten vertegenwoordigen – ME/cvs, MS en gezonde controles. De onderzoekers hadden echter enige moeite met het aanvullend onderscheiden van de ziekte-ernst van ME/cvs.
Dit wordt hieronder gevisualiseerd in een vereenvoudigde versie van de figuren in de paper. Zoals te zien is in figuur 1, kon LDA de ramangegevens scheiden in drie clusters (ME/cvs, MS en gezonde controles). Echter, bij het aanpakken van de aanvullende taak om onderscheid te maken tussen de ziekte-ernst van ME/cvs, onthulde LDA afzonderlijke clusters voor ernstige ME en gezonde controles, maar een overlap tussen milde en matige ME/cvs en MS (figuur 2). Hoewel verdere manipulatie van de gegevens een betere differentiatie mogelijk maakte, was het LDA-model slechts ongeveer de helft van de tijd nauwkeurig in het classificeren van de gegevens in de vijf groepen (milde, matige en ernstige ME/cvs; MS; en gezonde controles).
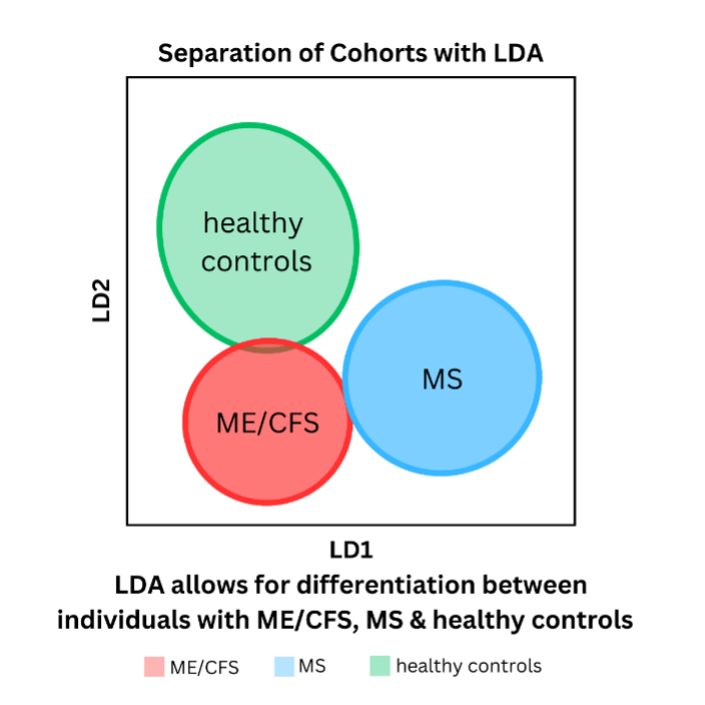
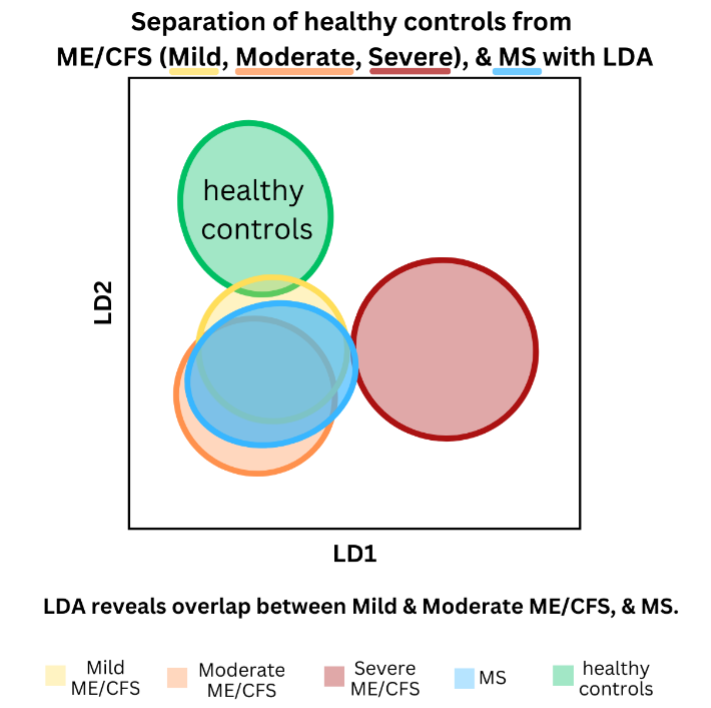
Opmerking: LD1 en LD2 in de bovenstaande figuren zijn gewoon twee theoretische ‘meetstokken’ die LDA gebruikt om verschillende perspectieven op de gegevens te krijgen.
Bovendien toonde LDA een universele toename van de aminozuren tryptofaan en tyrosine in alle subgroepen van ME/cvs en MS. Aan de andere kant was fenylamine, in vergelijking met controles, significant verlaagd bij matige en ernstige ME/cvs, maar verhoogd bij milde ME/cvs en MS. De onderzoekers suggereerden dat deze gemengde bevindingen te wijten kunnen zijn aan ‘metabole subtypes’ die bestaan bij mensen met ME/cvs. Gemengde bevindingen met betrekking tot niveaus van lipiden werden ook waargenomen.
Bevindingen van geavanceerde analyse van ramangegevens
Zoals eerder vermeld, streefden de onderzoekers naar een grotere nauwkeurigheid en maakten daarom gebruik van ensemble machine learning. Ze werden niet teleurgesteld: het ensemblemodel toonde een ‘verbeterde voorspellende kracht’ en bleek veel beter in staat om onderscheid te maken tussen ME/cvs-patiënten, MS-patiënten en gezonde controles, en ook tussen subgroepen van ME/cvs op basis van de ernst van de symptomen:
- De algehele nauwkeurigheid van het ensemblemodel bij het classificeren van ramangegevens als ME/cvs, MS of gezonde controle was 91%.
- De algemene nauwkeurigheid van het ensemblemodel bij het classificeren van ramangegevens in vijf groepen (milde, matige en ernstige ME/cvs; MS; en gezonde controles) was 84%.
Hoewel er nog ruimte is voor verbetering, zijn dit veelbelovende bevindingen.
Discussie
Volgens de onderzoekers “is dit het eerste onderzoek waarbij ramanspectroscopie en geavanceerde machine learning-technieken worden gebruikt om subgroepen van ME/cvs-patiënten te onderscheiden op basis van de ernst van de symptomen, met hoge nauwkeurigheid, gevoeligheid en specificiteit”. De bevindingen van de studie openen de mogelijkheid van een eenvoudige en minimaal invasieve diagnostische methode voor ME/cvs waarbij slechts een klein bloedmonster nodig is voor analyse. Ze wijzen er wel op dat de ramanspectroscopische benadering “nog niet gemakkelijk beschikbaar is in gecertificeerde diagnostische laboratoria”.
Hoewel dit een baanbrekende studie is, erkennen de onderzoekers dat het nog in de beginfase verkeert en dat de aanpak gevalideerd moet worden in grotere onderzoekspopulaties en verder geoptimaliseerd moet worden. Bovendien waren de bloedmonsters bevroren, omdat ze afkomstig waren van de UK ME/CFS biobank, en daarom zouden de onderzoekers de aanpak ter vergelijking ook willen testen op vers gefixeerde (niet-bevroren) monsters.
Lees meer over wat een effectieve diagnostische biomarker is.
Lees ook: Een mogelijke bloedtest voor ME/cvs?
© ME Research UK, 12 oktober 2023. Vertaling admin, redactie NAHdine, ME-gids.





