Charlotte Stephens, ME Association, 17 augustus 2018
 In dit samenvattend onderzoeksoverzicht kijken we naar het groeiend bewijs voor abnormale naturalkillercelfunctie in ME/CVS en leggen uit wat deze belangrijke beschermers van het immuunsysteem zouden moeten doen om het lichaam tegen invasie te beschermen, en wat het zou kunnen betekenen wanneer ze niet goed functioneren.
In dit samenvattend onderzoeksoverzicht kijken we naar het groeiend bewijs voor abnormale naturalkillercelfunctie in ME/CVS en leggen uit wat deze belangrijke beschermers van het immuunsysteem zouden moeten doen om het lichaam tegen invasie te beschermen, en wat het zou kunnen betekenen wanneer ze niet goed functioneren.
Een recente en relatief grote studie uit Spanje heeft ons begrip van betrokkenheid van NK-cellen vergroot. We leggen uit wat de studie gevonden heeft en onderzoeken wat het kan betekenen in termen van de onderliggende ziekteproces(sen) in ME/cvs, en als een biomarker die zou kunnen helpen in de ontwikkeling van een diagnostische test die zou kunnen leiden tot een uiteindelijke behandeling. We bekijken ook wat ze ontdekt hebben over virale betrokkenheid in ME/cvs.
“Dit is zeker niet de eerste studie die afwijkingen in de naturalkillercellen (NK-cellen) vindt; er zijn er verschillende, die zelfs teruggaan tot 1987. In feite lijkt verminderde NK-celfunctie een van de meest consistente bevindingen van immuundisfunctie in ME/CVS.
Deze laatste studie is echter anders in die zin dat ze veel groter is dan voorgaande inspanningen (149 deelnemers, in vergelijking met 28-70 deelnemers in eerdere studies)…
Afwijkingen in NK-cellen zullen mogelijk op een dag een diagnose kunnen helpen bevestigen en ze dragen ook bij aan het bewijs van immuundisfunctie. Onderzoeksgegevens ondersteunen ook het idee van verschillende subgroepen onder de ME/CVS-paraplu die mogelijk verschillende pathologieën presenteren…”
Lees hieronder de volledige review:
Samenvattend overzicht: naturalkillercellen (NK-cellen) als een biomarker bij ME/cvs
Introductie
Association of T and NK Cell Phenotype with the Diagnosis of ME/CFS (Rivas et al. 2018)
[Verband tussen T- en NK-celfenotype met de diagnose van ME/CVS (Rivas et al., 2018)
Onlangs werd een relatief grote studie van een Spaanse onderzoeksgroep gepubliceerd die verschillen vond in de populaties van naturalkillercellen (NK-cellen) en T-cellen die zouden kunnen bijdragen aan de diagnose van ME/CVS.
“Dit is zeker niet de eerste studie die afwijkingen in de naturalkillercellen (NK-cellen) vindt; er zijn er verschillende, die zelfs teruggaan tot 1987. In feite lijkt verminderde NK-celfunctie een van de meest consistente bevindingen van immuundisfunctie in ME/CVS.
Deze laatste studie is echter anders in die zin dat ze veel groter is dan voorgaande inspanningen (149 deelnemers, in vergelijking met 28-70 deelnemers in eerdere studies).
Belangrijke hoogtepunten uit de recente studie
- Subpopulaties van NK- en T-cellen waren significant verschillend bij de ME/CVS-patiënten in vergelijking met gezonde controles.
- Deze verschillen werden gebruikt om een programma te genereren dat in staat was om 70% van de mensen met ME/CVS correct te onderscheiden van de controles.
- De gevonden verschillen zouden een onderscheidend immunologisch profiel kunnen definiëren dat zou kunnen helpen in het diagnostisch proces, evenals bijdragen aan de herkenning van de ziekte en helpen bij meer specifieke behandelingen.
In dit samenvattend overzocht hopen we je wat achtergrondkennis te bieden over naturalkillercellen, zodat je beter zal begrijpen hoe dit recente onderzoek bijdraagt aan onze kennis van ME/cvs.
Afwijkingen in NK-cellen zullen misschien op een dag kunnen helpen om een diagnose te bevestigen en ze dragen ook bij aan het bewijs van immuundisfunctie. Onderzoeksgegevens ondersteunen ook het idee van verschillende subgroepen onder de ME/cvs-paraplu die mogelijk verschillende pathologieën presenteren.
Hoe werken naturalkillercellen?
Naturalkillercellen (NK-cellen) zijn een type witte bloedcellen die een deel van het immuunsysteem vormen. Ze vertegenwoordigen ongeveer 10% van onze totale witte bloedcellen, dus we hebben relatief kleine hoeveelheden, maar ze spelen een zeer belangrijke rol (Paust et al., 2011).
Ze zijn het “eerstehulpteam”, dat optreedt als bewakers op patrouille; ze circuleren rond in het lichaam op zoek naar potentiële bedreigingen, zoals virussen of kankercellen.
Wanneer ze een van deze indringercellen opmerken, “vallen” ze aan door chemische bommen vrij te geven (perforines en granzymes genoemd) die gaten in de cellen slaan waardoor ze sterven (via een proces dat apoptose genoemd wordt). Dit staat bekend als cytotoxische activiteit (Brenu et al., 2013).
Terwijl ze bezig zijn met het bedwingen en het aanvallen van de bedreiging, roepen ze versterkingen in (andere immuuncellen) door cytokines te produceren (chemische boodschappers) en wachten dan op ondersteuning, in de vorm van T-cellen, die specifieke antilichamen produceren tegen de bedreiging.
Hoe herkennen NK-cellen “bedreigingen”?
Alle cellen in ons lichaam hebben kleine markers op zich – labels of tags – die immuuncellen vertellen dat ze “lichaamseigen” cellen zijn en niet vreemd.
Wanneer NK-cellen deze tags lezen, wordt hun cytotoxische (dodende) activiteit uitgeschakeld.
Cellen die geïnfecteerd worden door virussen, brengen deze “lichaamseigen” tags niet tot expressie en zo zijn NK-cellen in staat om ze te detecteren en ze vervolgens te vernietigen.
NK-cellen herkennen ook lipopolysacchariden (LPS), een component van bacteriële cellen, die ook cytotoxische activiteit van NK-cellen uitlokken (Brenu et al., 2013).
Ze reageren ook op “noodsignalen” die afgegeven worden door geïnfecteerde cellen, in de vorm van cytokines.
Subtypes van NK-cellen
Er zijn verschillende soorten NK-cellen met licht verschillende eigenschappen, bepaald door het type oppervlaktemarkers die ze tot expressie brengen. Hieronder volgen de belangrijkste typen die in de huidige studie verschillend zijn bevonden:
- NKT -achtige cellen zijn NK-cellen die een type “geheugen” ontwikkeld hebben voor bepaalde type cellen en zo een specifiek virus kunnen herkennen, mocht je een tweede keer geïnfecteerd worden. Dit is vergelijkbaar met de rol van T-cellen.
- CD56bright subgroep van NK-cellen vertegenwoordigen gewoonlijk ongeveer slechts 10% van de NK-cellen en ze scheiden meer cytokinen uit dan de andere types, in het bijzonder IFNy. Ze hebben echter een zeer lage cytotoxische activiteit (dodingscapaciteiten). Ze hebben ook een langere levensduur en kunnen T-celproliferatie (vermenigvuldiging) induceren dat tot auto-immuniteit ken leiden en bijdragen aan inflammatie.
- NKG2C en NKCD69 – beiden zijn markers die geactiveerde NK-cellen laten zien.
(Mandal and Viswanathan, 2015)
Regulerende T-cellen
De andere types cellen bestudeerd in dit laatste onderzoek waren regulerende T-cellen, een immuuncel die andere immuuncellen kan reguleren of onderdrukken.
Regulerende T-cellen onderdrukken actief de activatie van het immuunsysteem en helpen auto-immuunziekte voorkomen – waarbij het immuunsysteem van het lichaam zijn eigen cellen begint aan te vallen.
Bestaande kennis van NK-cellen bij ME/CVS
Er zijn sinds 1987 meer dan 20 studies over NK-cellen bij ME/cvs gepubliceerd, die bijna allemaal concludeerden dat de cytotoxiciteit van NK-cellen verminderd is bij mensen met ME/cvs (Strayer et al., 2015). Dit betekent dat hun dodingscapaciteiten niet erg goed zijn.
Caligiuri et al. (1987) vonden dat de populaties van NK-cellen bij mensen met ME/CVS helemaal omgekeerd waren; de hoofdtypes van NK-cellen die gevonden worden bij gezonde mensen, werden in lage aantallen gevonden bij mensen met ME/cvs en het type dat in lage aantallen voorkomt bij gezonde mensen, was erg hoog bij mensen met ME/CVS.
“Bij het testen op cytotoxiciteit tegen verschillende doelcellen, toonden patiënten met CVS consistent lage dodingsniveaus” en ook “de meeste patiënten bleven niet in staat om met Epstein-Barrvirus geïnfecteerde B-celdoelen te lyseren.”
Cligiuri et al., 1987
Andere studies hebben verminderde niveaus van perforine gevonden; de “chemische bom” die door NK-cellen gebruikt wordt om andere cellen aan te vallen (Maher et al., 2015).
Een veel langere studie van 12 maanden in 2012 door Brenu et al. vond ook verminderde cytotoxische activiteit van NK-cellen bij mensen met ME/cvs die consistent was gedurende de periode van 12 maanden.
Studies hebben ook een verband gevonden tussen lage activiteit van NK-cellen en de ernst van symptomen; hoe lager de activiteit, hoe ernstiger de aandoening (Fletcher et al., 2010).
Natuurlijk zijn er ook studies geweest die geen verschillen gevonden hebben in NK-cellen bij mensen met ME/cvs. Dit zou te wijten kunnen zijn aan verschillen in methoden gebruikt in verschillende studies of te wijten aan de heterogene aard van ME/cvs (verschillende oorzaken/presentaties en mogelijke subgroepen met dezelfde diagnose).
 Bloedinzameling en -verwerking
Bloedinzameling en -verwerking
Interessant is dat een van de papers (Theorell et al., 2017) die niet in staat was om afwijkingen te vinden in populaties van NK-cellen – bij mensen met ME/cvs en gezonde controles – een methode van invriezen en vervolgens ontdooien van hun bloedstalen gebruikte vooraleer ze te verwerken.
Dit was verschillend ten opzichte van andere studies (waaronder de huidige) die het testen en analyseren deden onmiddellijk na bloedafname, op vers bloed.
Deze andere aanpak zou bijgedragen kunnen hebben aan de resultaten. De auteurs van deze paper hebben er zelfs zelf commentaar op gegeven:
“De timing van functionele testen ten opzichte van isolatie van PBMC ’s kan verschillen verklaren, met een effect van oplosbare factoren, zoals cytokines, catecholamines, en hormonen die afnemen na verloop van tijd na het isoleren uit volledig bloed. Een dergelijke discrepantie zou daarom suggereren dat NK-cellen van ME/cvs-patiënten over het algemeen intrinsiek normaal zijn, maar mogelijk reageren op een abnormale externe omgeving, waardoor ze hypofunctioneel zijn in volledig bloed of onmiddellijk na isolatie.”
Theorell et al., 2017.
Wat zij suggereerden, was dat de NK-cellen zelf normaal functioneren, maar dat in het bloed van mensen met ME/CVS hun functie verminderde, misschien door de effecten van een andere factor die abnormaal is in het bloed van de patiënten.
De recente Spaanse studie
Association of T and NK Cell Phenotype with the Diagnosis of ME/CFS (Rivas et al. 2018)
[Verband tussen T- en NK-celfenotype met de diagnose van ME/CVS (Rivas et al., 2018)
Het doel van de studie was om verder verschillen in subpopulaties van T- en NK-cellen te onderzoeken die geïdentificeerd werden in de eerdere studies om hun gebruik in het verbeteren van diagnose en karakterisering van ME/cvs te beoordelen.
De groep hoopte om een beperking van eerdere studies van een kleine steekproefgrootte weg te werken door een grotere cohort patiënten te gebruiken. Ze keken ook of er verbanden bestonden tussen immuunceltypes en ernst van de ziekte, ontstaan van de ziekte en virale betrokkenheid (EBV en HCMV).
Immunofenotypering (identificeren van subgroepen van verschillende types immuuncellen) werd uitgevoerd op het volledig bloed van 76 patiënten (die voldeden aan de herziene Canadese Consensuscriteria, evenals een beoordeling door een medisch professional) en 73 gezonde controles.
ME/cvs-patiënten werden van de studie uitgesloten als ze een andere medische aandoening hadden die hun symptomen kon verklaren.
Interessant is dat controles uitgesloten werden als ze een eerste- of tweedegraadsverwante hadden met ME/cvs. Dit is geen uitsluiting die in veel studies gezien wordt (ik heb er sowieso geen enkele gelezen), en weerspiegelt dat er misschien een erfelijke component voor ME/cvs is die nog geïdentificeerd moet worden.
Vreemd genoeg is er echter geen sprake van uitsluiting van controles die ook een andere medische aandoening hadden, die mogelijk de resultaten hadden kunnen beïnvloeden.
In tegenstelling tot sommige eerdere studiebevindingen die geen verschillen in immuuncellen vonden, analyseerde deze studie vers (geen ingevroren) volledig bloed binnen zes uur na afname.
Dit geeft de dichtste weergave van wat er zich in het lichaam afspeelt, en, “…heeft mogelijk gezorgd voor de detectie van veranderingen die verloren zouden kunnen gaan wanneer er een meer verwerkt monster wordt gebruikt.”
Ze onderzochten dan de percentages van verschillende immuuncellen (CD4 en CD8 T-cellen, regulerende T-cellen en verschillende subpopulaties van NK-cellen) en vergeleken de hoeveelheid tussen patiënten en controles.
Wat hebben ze gevonden?
ME/cvs-patiënten vertoonden significant lagere waarden van regulerende T-cellen en hogere NKT-achtige cellen dan de gezonde controles.
Met betrekking tot de fenotypes van NK-cellen, was NKG2C significantlager en NKCD69- en NKCD56bright waren significant hoger in de patiëntengroepen (zie figuur 2 en 3 hieronder).
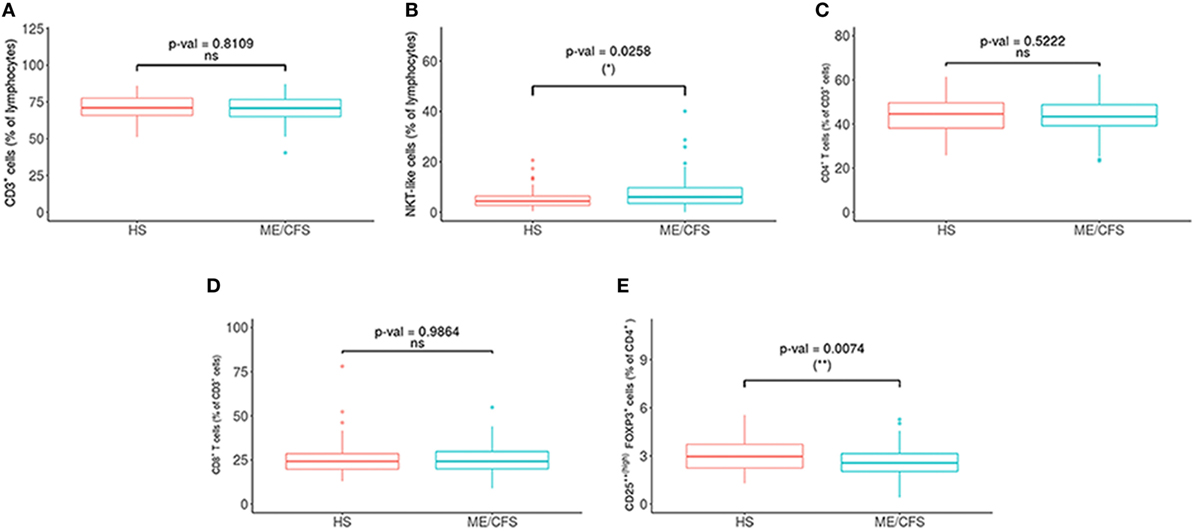
Figuur 2. Vergelijking van lymfocytensubsets bij patiënten met myalgische encefalomyelitis / chronisch vermoeidheidssyndroom (ME / CVS) (n = 76) en gezonde proefpersonen (n = 73). (A) Percentages van T (CD3+) en (B) NKT (CD3+ CD16+/- CD56+) cellen werden geanalyseerd in ‘gated’ CD45+ lymfocyten. (C, D) Percentages van CD4+ en CD8+ werden verkregen na ‘gating’ van CD3+ lymfocyten. (E) Het percentage van regulerende T-cellen [CD25++(hoog) FoxP3+] werd verkregen na ‘gating’ van CD4 + T-cellen. Cijfers tonen mediaanwaarden (lijnen), interkwartielbereiken (vakken) en 10-90 percentielwaarden (balken). P-waarden verkregen via Wilcoxon niet-parametrische test. © Rivas et al., 2018
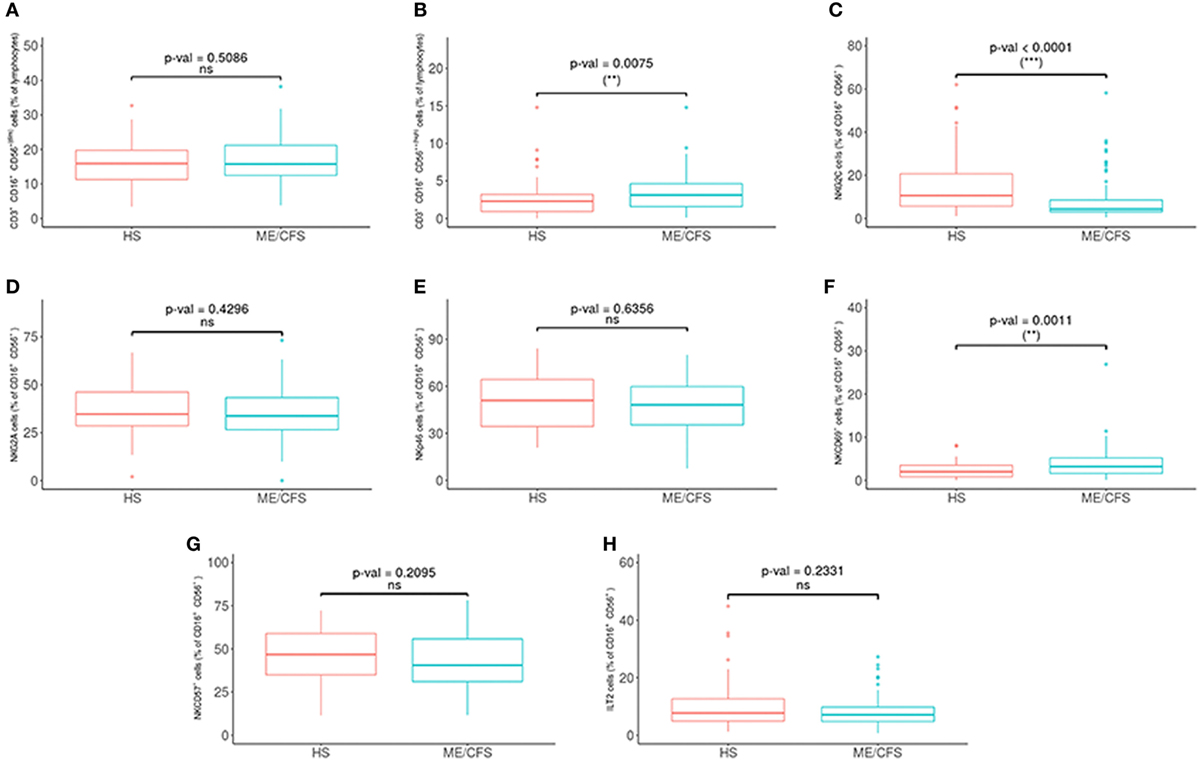
Figuur 3. Analyse van NK-cel-subgroepen bij patiënten met myalgische encefalomyelitis / chronisch vermoeidheidssyndroom (ME / CVS) (n = 76) en gezonde proefpersonen (n = 73). (A, B) NK-cellen als CD16+/- CD5 + (dim) en CD16+/- CD56++ (hoog) werden verkregen in ‘gated’ CD45+ lymfocyten. (C-H) Percentages van NKG2C, NKG2A, NKp46, NKCD69, NKCD57 en ILT2 NK-cellen werden verkregen na ‘gating’ voor CD16+/- CD56+ lymfocyten. Cijfers tonen mediaanwaarden (lijnen), interkwartielbereiken (vakken) en 10-90 percentielwaarden (balken). p-waarden verkregen via Wilcoxon niet-parametrische test. © Rivas et al., 2018
Wat betekent dit?
Veel van deze bevindingen suggereren een auto-immuunbetrokkenheid bij ME/CVS.
Regulerende T-cellen zijn betrokken in het voorkomen van auto-immuniteit, en de niveaus hiervan bleken laag te zijn bij ME/cvs. Regulerende T-cellen bleken ook lager te zijn in auto-immuunziekten zoals reumatoïde artritis en systemische lupus erythematosus (Barreto, et al. 2009; Kawashiri et al., 2011).
In feite was dit een van de voorgestelde redeneringen achter de mogelijke behandeling van ME/cvs met rituximab.
Er zijn ook verhoogde niveaus van NKCD69 gevonden in infectieuze en auto-immuunpathologieën (Rodriguez-Muñoz et al., 2016).
In een studie met reumatoïde artritis die geïnduceerd werd bij muizen, speelde CD69 een sleutelrol in de auto-immuunpathologie en inflammatie door TGF-bèta te verhogen, een cytokine waarvan systematisch aangetoond dat ze verhoogd is bij ME/cvs-patiënten (Zhang et al., 2011; Blundell et al., 2015).
De CD56bright NK-cellen produceren hoge niveaus van een bepaalde cytokine die interferon gamma (IFNγ) wordt genoemd. Verhoogde expressie van IFNγ wordt geassocieerd met een aantal auto-inflammatoire en auto-immuunziekten, waaronder systemische lupus.
Interferon gamma (IFNγ) heeft ook het vermogen om virale replicatie direct te remmen en verhoogde niveaus van IFNy zijn in verband gebracht met hoge niveaus van reactivatie van EBV (Epstein-Barrvirus) (Cardenas-Mondragon et al., 2017).
Hoe helpt dit bij diagnostiek?
De onderzoekers hebben de resultaten gebruikt die het meest verschillend waren tussen ME/cvs-patiënten en gezonde controles om een programma te creëren dat zou proberen te identificeren of iemand ME/cvs had op basis van deze bevindingen van immuuncellen.
Door dit programma te gebruiken waren ze in staat om personen correct te identificeren als hetzij ME/cvs-patiënten, hetzij gezonde controles in 70% van de gevallen (wat zich vertaalt in ongeveer 3 op de 4 patiënten).
Verdere onderzoeken
Het onderzoeksteam onderzocht ook het verband tussen de fenotypes van de immuuncellen en de ernst van de vermoeidheid, met behulp van vragenlijsten. Ze zagen echter geen significant verband tussen eender welke celfenotypes en de mate van ernst.
De ME/cvs-patiënten werden dan opgesplitst in twee subgroepen; degenen wiens ziekte uitgelokt was door een infectie en degenen bij wie dat niet het geval was. De fenotypes van de twee groepen werden vergeleken en er werd een significant verschil waargenomen in twee verschillende subgroepen van NK-cellen.
Zou deze bevinding potentieel een diagnostische tool kunnen zijn die gebruikt kan worden om onderscheid te maken tussen twee subgroepen van ME/cvs-patiënten? Subgroepen met mogelijk verschillende onderliggende ziektemechanismen, en misschien verschillende behandelingstrajecten?
Groepen op basis van ontstaan van ziekte
Er werden verhoogde niveaus van NKT-achtige cellen gevonden in de groep patiënten die een infectie voor het begin van de ziekte beschreven hadden. Deze populaties spelen een rol in de regulering van de immuunrespons via hun cytokines.
Er werden hogere niveaus van CD56bright-NK-cellen gevonden in de groep die “geen infectie” beschreef voor het begin van de ziekte, waarvan de onderzoekers veronderstelden dat dit te wijten zou kunnen zijn aan blootstelling aan verhoogde niveaus van catecholamines (bijnierhormonen zoals adrenaline) als een gevolg van chronische activatie van de HPA-as (hypothalamus-hypofyse-bijnier-as) (het centrale stressresponssysteem), zoals beschreven door Loebel et al., 2016.
EBV (Epstein-Barrvirus)
Niveaus van antilichamen tegen EBV (verantwoordelijk voor veel ziekten en geopperd als een trigger voor ME/cvs, zoals klierkoorts) en HCMV (humaan cytomegalovirus) werden bepaald en vergeleken tussen de patiënten en gezonde personen.
Er werd geen verschil gevonden tussen de patiënten en gezonde personen met betrekking tot de prevalentie van positieve antistoffen. Dit betekent dat de mensen met ME/cvs niet meer of minder antistoffen tegen EBV hadden dan de gezonde controles (zie tabel 3).
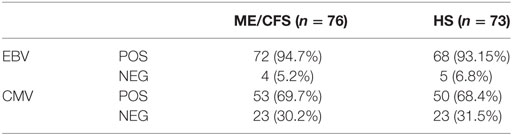
Tabel 3. Prevalentie van positieve en negatieve IgG-anti-Epstein-Barrvirussen (EBV) VCA- en CMVH-serologie, bij patiënten met myalgische encefalomyelitis / chronisch vermoeidheidssyndroom (ME / CVS) en gezonde proefpersonen. © Rivas et al., 2018
Dit is interessant omdat virussen zoals EBV vaak verondersteld worden als oorzaken van ME/cvs. Dit resultaat toont aan dat het niet noodzakelijk het virus is, maar eerder dat de respons van het immuunsysteem op het virus mogelijk het probleem is.
Nog interessanter was dat bijna 95% van de deelnemers in de studie (inclusief gezonde controles) antistoffen hadden tegen EBV, wat suggereert dat bijna iedereen op een gegeven moment in hun leven geïnfecteerd was geweest.
Deze antistoffen tegen EBV zijn echter niet erg specifiek; ze tonen enkel aan dat je op een gegeven moment in je leven geïnfecteerd bent geweest met het virus, het toont niet aan of het virus nog steeds in je lichaam aanwezig is; in een actieve of latente staat.
Scheibenbogen et al. (2014) had DNA-sequenties van EBV in B-cellen van ME/cvs-patiënten gedetecteerd, die virale activiteit konden onthullen, ook al zou het antilichaamprofiel vergelijkbaar zijn met gezonde controles.
Discussie
Verminderde cytotoxische activiteit van NK-cellen wijst mogelijk op een verlaagde immuniteit en daarom een verhoogde vatbaarheid voor infecties.
Toch lijkt uit anekdotisch bewijs dat mensen met ME/cvs ofwel uiterst vatbaar zijn voor nieuwe infecties en/of terugkerende infecties hebben, ofwel dat ze bijna nooit infecties krijgen.
Het zou daarom interessant zijn om te zien of er verschillen zijn in de populaties van NK-cellen tussen deze twee subgroepen van mensen binnen de ME/cvs-gemeenschap.
Opmerkelijk is dat slechts 41% van de patiënten in deze studie rapporteerden dat hun ziekte uitgelokt werd door een infectie. Het zou interessant zijn om te zien of deze resultaten alleen te zien zijn bij patiënten bij wie de ziekte uitgelokt werd door een infectie, om te zien of de resultaten meer of minder significant zouden zijn.
Lage NK-celactiviteit is geassocieerd met een verhoogde vatbaarheid voor herpesvirussen (vb. EBV). Zou deze lagere NK-celfunctie die gevonden wordt bij mensen met ME/cvs, feitelijk de reden zijn waarom ze vatbaarder waren om de infectie te krijgen die hun ME/cvs aanvankelijk uitlokte?
Aan de ander kant zijn de verschillen in NK-cellen misschien geen oorzakelijke factor in ME/cvs, maar eerder een gevolg van het hebben van de ziekte.
Studies naar NK-cellen hebben gekeken naar het verband met de ernst van de ziekte, maar niet de duur. Deze studie had een gemiddelde ziekteduur van 17 jaar, wat vrij lang is.
Het zou interessant zijn om te zien of deze verschillen in NK-cellen veranderen in de loop van de ziekte en het kan een beter idee geven of het het NK-celfenotype is dat mensen vatbaarder maakt om ME/cvs te krijgen of dat het een gevolg is van het hebben van de ziekte.
Hoewel de test met het computerprogramma veelbelovend was omdat het 3 op de 4 patiënten correct diagnosticeerde, is dit misschien niet haalbaar in een huisartsenpraktijk omdat ze vers bloed gebruikten. In werkelijkheid zouden bloedmonsters ingevroren worden en niet binnen de zes uur verwerkt worden, zoals in deze studie.
Mogelijke oorzaken van verlaagde NK-celfunctie
- Psychologische en fysieke stress – het gevolg daarvan (cortisol) kan de NK-celfunctie remmen (Sieber et al., 1992; Witek-Janusek et al., 2008),
- Darmdysbiose – beïnvloedt het immuunsysteem (er is aangetoond dat probiotica de NK-celfunctie kunnen verbeteren (Gill et al., 2001; Chiang et al., 2000; Takeda et al., 2006),
- B12-tekort (Tamura et al., 1999)
- Kanker, virale infecties, MS, reumatoïde artritis en systemische lupus
Mogelijke manieren om de NK-celfunctie te verbeteren
- Verminder stress
- Glutathion – dit is nodig om de chemische stoffen te produceren die NK-cellen vrijgeven, dus lage niveaus van glutathion kunnen tot een verminderde NK-celfunctie leiden (Millman, 2008). Oxidatieve stress en lage glutathionniveaus zijn gevonden in ME/cvs en worden verondersteld als oorzakelijke factoren (Shungu et al., 2012),
- Supplementen – curcumine, magnesium, probiotica, B12, ginseng, echinacea, chlorella, co-enzym Q10 (Ravaglia et al., 2000; Kwak et al., 2012; Currier et al., 2001; Partearroyo et al., 2013; Chaigne-Delalande et al., 2013; Fiala, 2015).
Conclusie
Uit dit laatste onderzoek en veel ander studies over dit onderwerp, lijkt het duidelijk dat er sterk bewijs is van verminderde NK-celfunctie in ME/cvs. Onderzoek moet echter nog de oorzaak, en ook de behandeling van deze afwijkingen identificeren.
Deze bevindingen zouden uiteindelijk kunnen helpen bij de diagnose van ME/cvs. Verschillen in de gebruikte methoden in deze studies naar NK-cellen hebben het echter moeilijk gemaakt om de resultaten ervan onderling te vergelijken of de NK-celfunctie te gebruiken als een consistente biomarker (Brenu et al., 2013).
Bijkomend betekent de heterogene aard van deze ziekte dat het misschien geen geschikte biomarker is voor iedereen die momenteel de diagnose ME/cvs heeft.
Het is belangrijk op te merken dat de gevonden afwijkingen in NK-cellen in deze studie een vermindering in functie zijn, geen vermindering in het aantal NK-cellen; patiënten hebben genoeg cellen, maar ze doen gewoon hun werk niet goed! Het is niet iets dat routinematig getest kan worden door je huisarts.
Deze bevindingen over immuuncellen dragen verder bij aan het bewijs van immuundisfunctie en mogelijke auto-immune betrokkenheid in de pathologie van ME/cvs.
De auteurs concludeerden:
De waargenomen verschillen in sommige van de subpopulaties van T- en NK-cellen tussen patiënten en gezonde controles zouden een verschillend immunologisch profiel kunnen definiëren dat kan helpen in het diagnostisch proces van ME/cvs-patiënten, en kan bijdragen aan de herkenning van de ziekte en de zoektocht naar meer specifieke behandelingen.
Er zijn echter meer studies nodig om deze bevindingen te bevestigen en bij te dragen aan het bereiken van een consensus in diagnose.”
Association of T and NK Cell Phenotype with the Diagnosis of ME/CFS (2018)
Referenties
Barreto, M., Ferreira, R.C., Lourenço, L., Moraes-Fontes, M.F., Santos, E., Alves, M., et al. (2009) Low frequency of CD4+CD25+ Treg in SLE patients: a heritable trait associated with CTLA4 and TGFbeta gene variants. BMC Immunology 10:5.
Brenu, E., Mieke, L., Staines, D., Ashton, K., Hardcastle, S., Keane, J., et al. (2012) Longitudinal Investigation of natural killer cells and cytokines in chronic fatigue syndrome/myalgic encephalomyelitis. Journal of Translational Medicine 10: 88.
Brenu, E., Harcastle, S., Atkinson, G. et al. (2013) Natural Killer Cells in Patients with Severe Chronic Fatigue Syndrome. Auto Immune Highlights 4 (3): 69-80.
Blundell, S, Ray, KK, Buckland, M, White, PD. (2015) Chronic fatigue syndrome and circulating cytokines: a systematic review. Brain Behaviour and Immunology 50:186–95
Caligiuri, M., Murray, C., Buchwald, D., Levine, H., Cheney, P., Peterson, D., Komaroff A., and Ritz J. (1987) Phenotypic and functional deficiency of natural killer cells in patients with chronic fatigue syndrome. Journal of Immunology 139 (10): 3306-3313.
Cardenas-Mondragon, M., Torres, J., Sanchez-Zauco, N., Gomez-Delgado, A., et al. (2017) Elevated Levels of Interferon-y Are associated with High Levels of Epstein-Barr Virus Reactivation in Patients with the Intestinal Type of Gastric Cancer, Journal of Immunology Research, 10.
Chaigne-Delande, B., Li, F, O’Connor, G. et al. (2013) Mg2+ regulates cytotoxic functions of NK and CD8 T cells in chronic EBV infection through NKG2D, Science 341 (6142): 189-191.
Chiang, BL, Sheih, YH, Wang, LH, Liao, CK, Gill, HS (2000) Enhancing immunity by dietary consumption of a probiotic lactic acid bacterium (Bifidobacterium lactis HN019): optimization and definition of cellular immune responses, European Journal of Clinical Nutrition 54(11): 849-855.
Currier, N. and Miller, S. (2001) Echinacea purpurea and melatonin augment natural-killer cells in leukemic mice and prolong life span. Journal of Alternative and Complimentary Medicine 7 (3): 241-251.
Fiala, M. (2015) Curcumin and omega-3 fatty acids enhance NK cell-induced apoptosis of pancreatic cancer cells but curcumin inhibits interferon-γ production: benefits of omega-3 with curcumin against cancer, Molecules 20 (2): 3020-6.
Fletcher MA, et al. (2010) Biomarkers in chronic fatigue syndrome: evaluation of natural killer cell function and dipeptidyl peptidase IV/CD26. PLoS One. 5(5): e10817.
Gill, HS, Rutherfurd, KJ, Cross, ML (2001) Dietary probiotic supplementation enhances natural killer cell activity in the elderly: an investigation of age-related immunological changes, Journal of Clinical Immunology 21(4): 264-71.
Kawashiri, SY., Kawakami, A., Okada, A., Koga, T., Tamai, M., Yamasaki, S., et al. (2011) CD4+CD25(high)CD127(low/-) Treg cell frequency from peripheral blood correlates with disease activity in patients with rheumatoid arthritis. Journal of Rheumatology 38 (12): 2517–21.
Kwak, J., Baek, S., Woo, Y., Han, J., Kim, B. and Lee, J. (2012) Beneficial immunostimulatory effect of short-term Chlorellasupplementation: enhancement of Natural Killercell activity and early inflammatory response (Randomized, double-blinded, placebo-controlled trial) Nutrition Journal 11: 53.
Loebel M, Strohschein K, Giannini C, Koelsch U, Bauer S, Doebis C, et al. (2014) Deficient EBV-specific B- and T-cell response in patients with chronic fatigue syndrome, PLoS One 9 (1): e85387.
Loebel, M, Grabowski, P, Heidecke H, Bauer S, Hanitsch LG, Wittke K, et al. (2016) Antibodies to beta adrenergic and muscarinic cholinergic receptors in patients with chronic fatigue syndrome. Brain Behaviour and Immunology 52:32–9.
Maher, KJ., Klimas, NG and Fletcher, MA. (2005) Chronic fatigue syndrome is associated with diminished intracellular perforin. Clinical and Experimental Immunology 142 (3): 505-11.
Mandal, A. and Viswanatahn, C. (2015) Natural Killer Cells: In health and disease, Hematology/Oncology and Stem Cell Therapy 8 (2): 47-55.
Millman, A., Salman, M., Dayaram, Y., Connell, N. and Venketaraman, V. (2008) Natural killer cells, glutathione, cytokines, and innate immunity against Mycobacterium tuberculosis, Journal of Interferon and Cytokine Research 28 (3): 153-165.
Ojo-Amaize, E.A., Conley, J., Peter, J. (1994) Decreased Natural Killer Cell Activity Is Associated with Severity of Chronic Fatigue Immune Dysfunction Syndrome Clinical Infectious Disease. 18 (Supplement 1): S157-S159.
Partearroyo, T., Ubeda, N., Montero, A., Achon, M. and Moreiras, G. (2013) Vitamin B12 and Folic Acid Imbalance Modifies NK Cytotoxicity, Lymphocytes B and Lymphoprolipheration in Aged Rats, Nutrients 5 (12): 4836-4848.
Paust, S., Senman, B. and Andrion, U. (2011) Adaptive Immune responses mediated by natural killer cells, Immunological Reviews 235 (1): 286-296.
Ravaglia, G., Forti, P., Maioli, F., Bastagli, L. et al. (2000) Effect of micronutrient status on natural killer cell immune function in healthy free-living subjects aged ≥90y, The American Journal of Clinical Nutrition 71 (2): 590–598.
Rodríguez-Muñoz, A., Vitales-Noyola, M, Ramos-Levi, A, SerranoSomavilla, A, González-Amaro, R, Marazuela, M. (2016) Levels of regulatory T cells CD69(+)NKG2D(+)IL-10(+) are increased in patients with autoimmune thyroid disorders. Endocrine 51 (3):478–89.
Shungu, D., Weiduschat, N., Murrough, J., Mao, X., Pillemer, S., Dyke, J., Medow, M., Natelson, B. and Mathew, S. (2012) Increased ventricular lactate in chronic fatigue syndrome. III. Relationships to cortical glutathione and clinical symptoms implicate oxidative stress in disorder pathophysiology, NMR Biomedicine 25 (9): 1073-1087.
Sieber, J., Rodin, J., Larson, L., Ortega, S., Cummings, N., Levy, S., Whiteside, T., Herberman, R. (1992) Modulation of human natural killer cell activity by exposure to uncontrollable stress, Brain, Behavior, and Immunity 6(2): 141–156.
Strayer, D., Scott, V. and Carter, W. (2015) Low NK Cell Activity in Chronic Fatigue Syndrome (CFS) and Relationship to Symptom Severity. Journal of Clinical Cell Immunology 6: 348.
Takeda, K, Suzuki, T, Shimada, SI, Shida, K, Nanno, M, Okumura, K (2006) Interleukin‐12 is involved in the enhancement of human natural killer cell activity by Lactobacillus casei Shirota, Clinical and Experimental Immunology 146(1): 109-15.
Tamura, J., Kubota, K., Murakami, H., Sawamura, M., Matsushima, T., Tamura, T., Saitoh, T., Kurabayshi, H., Naruse, T. (1999) Immunomodulation by vitamin B12: augmentation of CD8+ T lymphocytes and natural killer (NK) cell activity in vitamin B12-deficient patients by methyl-B12 treatment, Clinical & Experimental Immunology 116 (1): 28–32.
Theorell, J., Bileviciute-Ljungar, I., Tesi, B., Schlums, H., Johnsgaard, H., et al. (2017) Unperturbed Cytotoxic Lymphocyte Phenotype and Function in Myalgic Encephalomyelitis/Chronic Fatigue Syndrome Patients. Frontiers in Immunology 8: 723.
Whiteside, TL; Friberg, D (1998). Natural killer cells and natural killer cell activity in chronic fatigue syndrome ., American Journal of Medicine 105 (3A): 27S–34S.
Witek-Janusek, L., Albuquerque, K., Chroniak, K., Chroniak, C., Durazo, R., Mathews, H.L. (2008) Effect of Mindfulness Based Stress Reduction on Immune Function, Quality of Life and Coping In Women Newly Diagnosed with Early Stage Breast Cancer, Brain, behavior, and immunity 22 (6): 969–981.
Witek-Janusek, L., Gabram, S. and Mathews, H. (2014) Psychologic stress, reduced NK cell activity, and cytokine dysregulation in women experiencing diagnostic breast biopsy, Psychoneuroendocrinoogy 32 (1): 22-35.
Zhang, HY, Liu, ZD, Hu, CJ, Wang, DX, Zhang, YB, Li, YZ. (2011) Up-regulation of TGF-beta1 mRNA expression in peripheral blood mononuclear cells of patients with chronic fatigue syndrome. J Formos Med Assoc 110 (11):701–4.
© ME Association. Vertaling Zuiderzon, redactie Abby, ME-gids.
Opnieuw gepubliceerd met vriendelijke toestemming van de Britse ME Association.
Engelse versie beschikbaar op hun website: www.measociation.org.uk






