De hersenen en de bloedvaten. Zo innig met elkaar verweven, maar zo zelden samen bestudeerd. Achteraf gezien is dat best vreemd, want bloedvaten hebben misschien wel meer te maken met het functioneren van de hersenen dan wat dan ook.
Qua gewicht zijn de hersenen bijna een nulliteit – ze nemen ongeveer 2% van ons lichaamsgewicht in beslag – maar hun bloedstromen zijn een ander verhaal. De hersenen ontvangen 15-20% van onze bloedvoorraad; dat wil zeggen dat ze misschien wel het meest bloedvatrijke en bloedvatafhankelijke orgaan in het lichaam zijn.
We weten al dat het spike-eiwit van het coronavirus bloedstolling veroorzaakt en dat er verschillende andere zaken (activering van bloedplaatjes, endotheeldisfunctie) verkeerd gaan met de bloedvaten. Dan lijkt het ook alleen maar logisch om na te gaan welke invloed het functioneren van de bloedvaten zou kunnen hebben op de hersenen bij langdurige COVID.
Natuurlijk is er ook de ME/cvs-invalshoek. We weten dat de bloedstroom naar de hersenen verminderd is bij ME/cvs, en er bestaat bewijs voor neuro-inflammatie, disfunctie van de basale ganglia, problemen met de prefrontale cortex, enz., maar totdat het coronavirus opdook, was er – met uitzondering van Ron Davis’ onderzoek naar de vervormbaarheid van rode bloedcellen – bijna geen aandacht voor factoren in het bloed.
Bij beide ziekten hebben de onderzoeken met beeldvorming van de hersenen de neiging om zich te beperken tot de hersenen en tot de hersenen alleen. Terwijl de bloedstromen binnen de hersenen vaak worden bekeken, wordt alles buiten de hersenen niet onderzocht. Dat was niet zo bij dit onderzoek dat door de PolyBio Research Foundation werd gefinancierd.
De Studie
Dat veranderde met de studie “Neuroinflammation in post-acute sequelae of COVID-19 (PASC) as assessed by [11C]PBR28 PET correlates with vascular disease measure” [Neuro-inflammatie in postacute sequelae van COVID-19 (PASC) zoals beoordeeld door [11C]PBR28 PET correleert met vasculaire ziektemaat] (het is momenteel een preprint) met Michael VanElzakker en Marco Loggia.
Deze studie heeft de vraag gesteld of er een correlatie bestaat tussen neuro-inflammatie in de hersenen en markers van bloedvatdisfunctie in het plasma; met andere woorden: er werd gevraagd of er bij mensen met een hoger niveau van bloedvatdisfunctie in het plasma ook sprake was van meer neuro-inflammatie in de hersenen.
Een positief resultaat zou een verband leggen tussen wat er in de bloedvaten in het lichaam gebeurt en schade aan de hersenen. We hebben al gehoord van de darm-hersenas. Nu hebben we dan ook de bloedvat-hersenas.
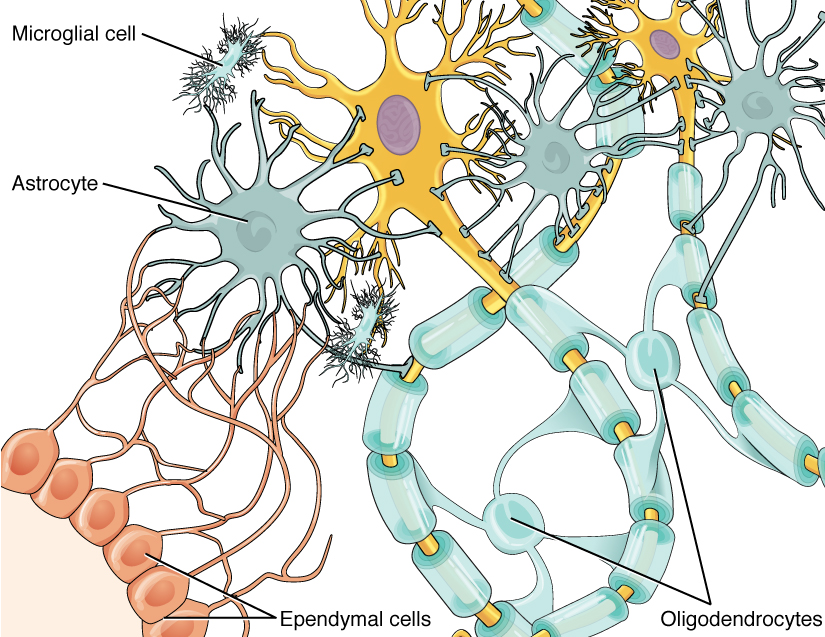
De onderzoekers keken specifiek naar de activiteit van de gliacellen in de hersenen. De cellen van de aangeboren immuniteit in de hersenen, de gliacellen, bestaan uit microgliacellen en astrocyten.
Dit zijn de cellen die de symptomen van “ziektegedrag” produceren (griepachtige symptomen zoals vermoeidheid, pijn, etc.) die we ervaren wanneer we te maken krijgen met een ziektekiem. Op korte termijn spelen ze een vitale rol bij het opruimen van ziekteverwekkers en van de schade die ze aan ons systeem hebben toegebracht. Maar als ze chronisch geactiveerd blijven, kunnen ze – naast het veroorzaken van veel symptomen – ook veel storingen veroorzaken die zich uiten in allerlei neurologische symptomen.
Aan het onderzoek namen 12 langdurige COVID-patiënten en 43 voor de pandemie gezonde controles deel. De auteurs gebruikten een ligand van de tweede generatie [11C]PBR28 dat gliale celactivering kan oppikken om neuro-inflammatie te meten, en analyseerden de volgende parameters in het plasma:
- Vasculaire gezondheid (α2- 238 macroglobuline, orosomucoïde, CRP [C-reactief proteïne], fetuin A, fibrinogeen, haptoglobine, 239 sL-selectine, PF4 [bloedplaatjesfactor 4], pentraxine-2)
- Cytokines (GM-CSF, IFNγ, IL-1β, IL-1RA, IL-2, IL-4, IL-5, IL-6, 241 IL-8, IL-10, IL-12(p40), IL-12(p70), IL-13, MCP-1, TNFα)
- Angiogenese (angiopoëtine-2, BMP-9, EGF, endogline, endotheline 243 1, FGF-1, FGF-2, follistatine, G-CSF, HB-EGF, HGF, IL-8, leptine, PLGF, VEGF-A, VEGF-244 C, VEGF-D).
(Het plasma is een lichtgekleurde vloeistof die overblijft in het bloed nadat de rode bloedcellen zijn verwijderd).
Ze evalueerden ook de symptomen met de Brief 252 Pain Inventory (BPI) en de Beck Depression Inventory (BDI). De patiënten werden gescreend om te voldoen aan een gemodificeerde versie van de Internationale Consensus Criteria (ICC) voor myalgische encefalomyelitis/chronischvermoeidheidssyndroom (ME/cvs). De meeste langdurige COVID-gevallen (10) waren niet opgenomen in het ziekenhuis voor COVID-19.
Resultaten
“Voor zover wij weten, is dit de eerste studie die direct bewijs levert dat processen die verband houden met neuro-inflammatie en vasculaire disfunctie, direct aan elkaar gerelateerd zijn bij PASC (langdurige COVID)”, aldus de auteurs.
Ze vonden bewijs van neuro-inflammatie (geactiveerde gliacellen) in een groot deel van de hersenen van langdurige COVID-patiënten. De ontstoken gebieden waren onder andere de midcingulate cortex, het corpus callosum, de thalamus, de basale ganglia/striatum, het subfornicaal orgaan, de cortex cingularis anterior, de mediale frontale gyrus en de precentrale gyrus.
Ze hebben echt de spijker op de kop geslagen met hun bloedvatparameters. Met verhogingen in 7 van de 9 vasculaire factoren (fibrinogeen, α2-macroglobuline, orosomucoïde (alfa-1-zuur glycoproteïne 427 of AGP), fetuin A, sL-selectine (oplosbaar leukocyt 428 selectine, of sCD62L), pentraxine-2 (serum amyloïde P component, of 429 SAP), haptoglobine), vonden ze sterke aanwijzingen voor vasculaire disfunctie.
Ze constateerden dat neuro-inflammatie positief gecorreleerd was met disfunctie van de bloedvaten (maar niet met cytokines of angiogenesefactoren); d.w.z. naarmate er meer aanwijzingen voor problemen met de bloedvaten werden gevonden in het plasma van de patiënt, werd er meer neuro-inflammatie gevonden.
Deze opwaarts gereguleerde vasculaire factoren triggeren onder andere stolling en gliacelactivering, halen immuunfactoren naar de bloedvaten en verhogen de permeabiliteit van de bloedvaten. Het interessante is dat het onderzoek verhoogde tekenen van neuro-inflammatie vond in sommige gebieden met dunne bloedvaatjes zoals de basale ganglia, die gevoeliger lijken te zijn voor schade.
Ook delen van de hersenen met de naam circumventriculaire organen (CVO’s) missen een volledige bloed-hersenbarrière en lijken “bijzonder kwetsbaar om geactiveerd te worden door via het bloed overgedragen factoren”.
Deze via het bloed overgedragen factoren kunnen ontsteking uitlokken, openingen in de bloed-hersenbarrière maken, gliacellen activeren (die meer neuro-inflammatie en een lekkende bloed-hersenbarrière in de hand werken) en een ravage aanrichten in de bloedvaten.
De hersengebieden
In 2004 stelden Chaudhuri en Behan dat problemen in de basale ganglia, de thalamus, het limbisch systeem en hogere corticale centra de oorzaak waren van ‘centrale’ of door de hersenen veroorzaakte vermoeidheid. Deze gebieden waren ruimschoots aanwezig in dit nieuwste onderzoek.
Cortex cingularis anterior (ACC)
Van alle hersengebieden springen de cortex cingularis anterior (ACC) en de basale ganglia/striatum eruit als het gaat om ME/cvs. De ACC lijkt een soort favoriet te zijn bij ME/cvs. Hij is talloze malen in verband gebracht met vermoeidheid bij ME/cvs.
Net als alle hersengebieden is de ACC betrokken bij een meerdere functies, waaronder aandachtsverdeling, anticipatie op beloning, besluitvorming, impulscontrole – allemaal functies waar ik, in ieder geval, moeite mee heb. Het “anticiperen op beloning” is interessant omdat een lage beloning in verband wordt gebracht met vermoeidheid in de basale ganglia. De ACC verwerkt ook veel prikkels en is betrokken bij de controle over de motoriek. Hij lijkt een rol te gaan spelen wanneer inspanning nodig is om een taak te voltooien.
Een verminderde doorbloeding van de hersenen, verminderde glutathionspiegels en misschien energieproductie, gewijzigde metabolieten, gewijzigde connectiviteit geassocieerd met verhoogde vermoeidheid, disfunctionele motorische planning en verminderde acetylcarnitine-opname in de cortex cingularis anterior zijn allemaal aangetroffen bij ME/cvs.
De basale ganglia
De basale ganglia bevinden zich diep in de hersenen en hebben verbindingen met de hersenstam, de thalamus en andere gebieden. Dit is het dopamineproducerende centrum van de hersenen en een belangrijke facilitator van beweging. Stoornissen in de basale ganglia worden in verband gebracht met vermoeidheid bij zowel ME/cvs als multiple sclerose.
Andrew Miller – zijn door de CDC gefinancierde studie vond bewijs van significant verminderde activering in de basale ganglia – gelooft dat disfunctie van de basale ganglia van invloed kan zijn op de bewegingsproblemen bij ME/cvs, en dat het zowel fysieke als mentale vermoeidheid kan veroorzaken, omdat het meer moeite kost om iets te doen, enz.
Er zijn aanwijzingen dat de basale ganglia bij uitstek kwetsbaar zijn voor ontstekingen.
Lees ook: Unrewarding Reward: The Basal Ganglia, Inflammation and Fatigue In Chronic Fatigue Syndrome [in het Engels]
De thalamus
De thalamus, die net boven de hersenstam ligt, lijkt door zijn rol in het doorgeven van sensorische en motorische signalen van het lichaam naar de hersenen, een potentiële sleutelfactor te zijn in multisymptomatische en vermoeiende ziekten zoals langdurige COVID en ME/cvs. Nog zo’n hersengebied dat meerdere malen is opgedoken bij ME/cvs, zowel de thalamus als de basale ganglia hebben sterke verbindingen met de hersenstam.
Conclusie
Dit soort onderzoek dat meerdere systemen met elkaar probeert te verbinden, is hard nodig bij deze complexe ziekten. Het onderzoek was klein, maar de bevindingen – indien gevalideerd – zijn groot. De grote verschillen in neuro-inflammatie die werden gevonden (totaal geen ontsteking bij de gezonde controles) en het tamelijk dramatische bewijs van disfunctie van de bloedvaten (7/9 factoren verhoogd bij langdurige Covid) suggereerden dat de studie weliswaar klein was, maar op het juiste spoor zat.
Met andere woorden, dit was niet een van die onderzoeken waarvan men zegt “als we nog eens 100 mensen aan het onderzoek hadden toegevoegd, zou dit grensgeval misschien ‘significant’ worden”. Zelfs met deze paar patiënten waren de verschillen duidelijk.
Het verband tussen disfunctie van bloedvaten (maar geen immuunactivering) en neuro-inflammatie suggereert dat bloedvatproblemen wel eens een heel belangrijke rol zouden kunnen spelen bij deze ziekten. Dat is niet echt nieuw – Klaus Wirth en zijn collega’s stellen al een tijdje dat dit waar is bij ME/cvs – maar, zoals de auteurs opmerkten, is dit het eerste directe bewijs dat dit ook zo is.
Hoewel niemand denkt dat slechts één behandeling de oplossing zal zijn, suggereert het onderzoek dat het verbeteren van de bloedvatfunctie een significante invloed zou kunnen hebben op het functioneren van de hersenen (vermoeidheid, hersenmist, pijn, mobiliteit) en de algehele conditie. De oorzaak van de problemen met de bloedvaten is onduidelijk, maar zou kunnen ontstaan wanneer de overgebleven spike-eiwitten van het coronavirus stolsels produceren die de bloedvaten beschadigen.
De resultaten moeten worden gevalideerd in een grotere studie, maar het is moeilijk voor te stellen, gezien de bevindingen van deze studie, dat we die grotere studies niet zullen krijgen.
De kernpunten
- Hoewel de hersenen 15-20% van het bloed in het lichaam krijgen en misschien wel het orgaan zijn dat het rijkst is aan bloedvaten, beperken hersenstudies zich meestal alleen tot de hersenen. Nu er echter overvloedig bewijs is van bloedvatproblemen bij langdurige COVID, is dat aan het veranderen. Een recente studie van de PolyBio Research Foundation analyseerde zowel de neuro-inflammatie in de hersenen als de factoren die geassocieerd worden met schade aan de bloedvaten.
- De studie vond bewijs van wijdverspreide neuro-inflammatie bij langdurige COVID in verschillende gebieden die van bijzonder belang zijn voor ME/cvs. De cortex cingularis anterior (ACC), de basale ganglia en de thalamus zijn ook allemaal opvallend aanwezig bij ME/cvs. Verminderde activering van twee van deze gebieden – de ACC en de basale ganglia – is in verband gebracht met vermoeidheid en andere symptomen bij ME/cvs.
- Aangezien 7 van de 9 factoren die schade aan de bloedvaten veroorzaken, significant verhoogd waren bij langdurige COVID-patiënten, kwam schade aan de bloedvaten duidelijk naar voren. Belangrijker nog, de bloedvatfactoren waren positief gecorreleerd met de gevonden neuro-inflammatie; d.w.z. hoe slechter de bloedvaten eraan toe waren, hoe meer neuro-inflammatie er werd gevonden. Dat suggereerde dat schade aan de bloedvaten mogelijk bijdraagt aan de neuro-inflammatie in de hersenen en aan een groot scala symptomen die door de hersenen worden veroorzaakt, zoals vermoeidheid, chronische pijn, griepachtige symptomen en hersenmist.
- De auteurs speculeerden dat resterende reservoirs met het coronavirus de bloedstolling in gang zetten, die vervolgens de bloedvaten beschadigde en de hersenen openstelde voor inflammatoire factoren via een lekkende bloed-hersenbarrière.
© Health Rising, 20 december 2023. Vertaling Els, redactie admin, ME-gids.





