Onderzoekshoogtepunt
Solve ME/CFS Initiative, 20 maart 2018
Belangrijk om weten:
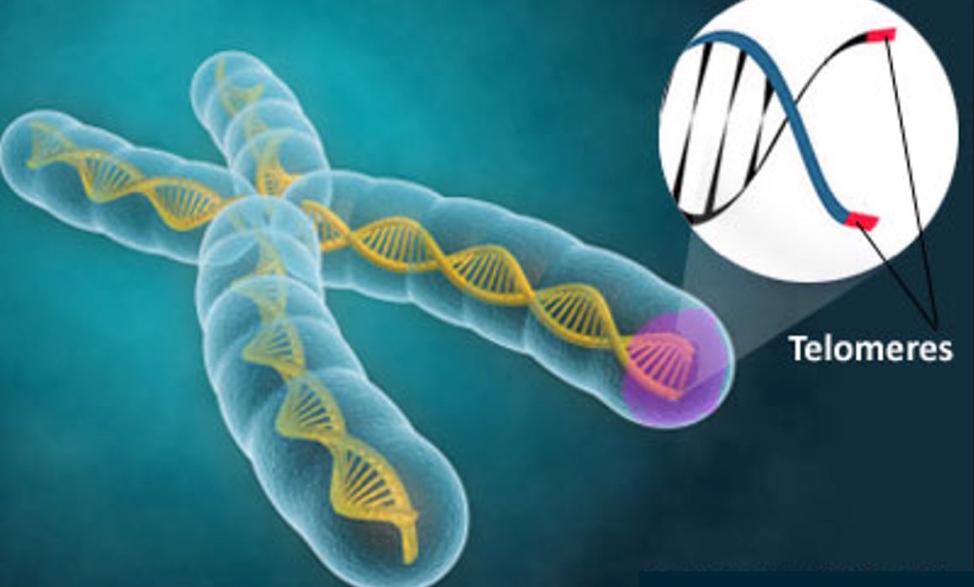
- Telomeren zijn delen van het DNA die de uiteinden van onze chromosomen aftoppen en beschermen tegen schade. Omdat deze codesequenties korter worden elke keer als de cel zich deelt, fungeren ze als een soort klok van de levensduur van een cel en beperken cellen tot een bepaald aantal replicaties (replicatieve senescentie). Dit mechanisme maakt het minder waarschijnlijk dat beschadigde, verouderde of gemuteerde cellen gerepliceerd zullen worden.
- Er is bewijs dat telomeerslijtage (verkorting) verband houdt met een waaier aan metabolische en inflammatoire ziekten.
- Rajeevan et al. vonden een significant verband tussen vroegtijdige telomeerslijtage en ME/CVS.
- Het verband bleek versterkt te worden door de variabele van geslacht – binnen de subgroep van vrouwelijke proefpersonen jonger dan 45 jaar hadden 95% van degenen met ME/CVS een telomeerlengte die korter was dan de gemiddelde lengte in de “niet-vermoeide” controlegroep.
- De auteurs wijzen op de mogelijkheid dat ME/CVS gecategoriseerd zou kunnen worden als een aandoening die verband houdt met versnelde veroudering, en dat er meer werk nodig is om de significantie bij ME/CVS aan te tonen.
Uniek inzicht in de biologische verschillen in myalgische encefalomyelitis / chronisch vermoeidheidssyndroom (ME/CVS) zijn voortgevloeid uit een follow-upfase van de surveillancestudie naar CVS in Georgia, een longitudinale studie van ME/CVS en vermoeidheidsziekten, gefinancierd door de Centers for Disease Control and Prevention (CDC). In hun paper getiteld “Association of chronic fatigue syndrome with premature telomere attrition” [Verband tussen chronisch vermoeidheidssyndroom met vroegtijdige telomeerslijtage] vonden Mangalathu et al. een significant verband tussen ME/CVS en vroegtijdige telomeerverkorting.
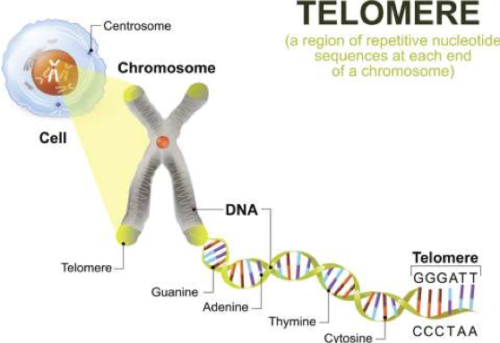 Telomeren zijn repetitieve sequenties aan de uiteinden van chromosomen die onze genetische data beschermen en celdeling mogelijk maken. De herhalingen waaruit een telomeer is opgebouwd, worden weggeërodeerd over verschillende delingscyclussen. Dit verkortingsproces wordt in verband gebracht met ouder worden en complexe ziekten zoals kanker. Door aan te tonen dat de studiegroep kortere telomeren heeft, ondersteunen de studieresultaten de hypothese dat ME/CVS in verband staat met versnelde veroudering.
Telomeren zijn repetitieve sequenties aan de uiteinden van chromosomen die onze genetische data beschermen en celdeling mogelijk maken. De herhalingen waaruit een telomeer is opgebouwd, worden weggeërodeerd over verschillende delingscyclussen. Dit verkortingsproces wordt in verband gebracht met ouder worden en complexe ziekten zoals kanker. Door aan te tonen dat de studiegroep kortere telomeren heeft, ondersteunen de studieresultaten de hypothese dat ME/CVS in verband staat met versnelde veroudering.
Rajeevan et al. gebruikten klinische en enquêtegegevens om 639 deelnemers te analyseren in de context van vier categorieën: (1) personen met chronisch vermoeidheidssyndroom (CVS) die voldeden aan de definitie uit 1994 [Fukuda-criteria, n.v.d.r.]; (2) personen met CVS en uitsluitingsaandoeningen; (3) degene die slechts voldeden aan enkele van de criteria voor CVS; (4) en “niet-vermoeide” personen. Telomeerlengte werd gemeten door DNA te isoleren uit bloedstalen en een kwantitatieve polymerasekettingreactie (PCR)-methode toe te passen.
De gemiddelde telomeerlengte verschilde licht per ziektegroep en was significant korter in alle ziektegroepen in vergelijking met de niet-vermoeide groep. Belangrijk is dat de bevinding van telomeerslijtage significant bleef na aanpassing voor leeftijd, geslacht, obesitas, en opleidingsniveau. De onderzoekers gingen dieper in op de gegevens en stratificeerden op basis van leeftijd en geslacht, waarbij men vond dat het verband tussen korte telomeren en ME/CVS het sterkst was bij vrouwelijke proefpersonen jonger dan 45 jaar. De bevindingen wezen er in feite op dat het verband tussen telomeerlengte en vermoeidheidsgroepen slechts significant was bij deelnemers jonger dan 45 jaar.
De auteurs opperen een aantal oorzakelijke verklaringen voor het waargenomen verband. Ze merkten op dat chronische inflammatie en oxidatieve stress, processen die verband houden met 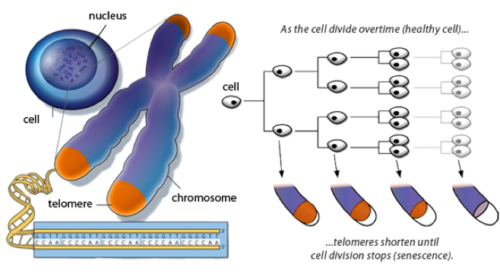 ME/CVS, mogelijk het gevolg zijn van telomeerverkorting. Anderzijds kan de richting van causaliteit in de tegenovergestelde richting gaan, nl. dat een verschil in telomeerlengte veroorzaakt wordt door infectie, stress of andere omgevingsfactoren. Rajeevan et al. concludeerden hun paper met het benadrukken van de noodzaak voor bijkomend onderzoek naar de significantie van versnelde veroudering bij ME/CVS door een grotere steekproef en verder verfijnde methodes te gebruiken:
ME/CVS, mogelijk het gevolg zijn van telomeerverkorting. Anderzijds kan de richting van causaliteit in de tegenovergestelde richting gaan, nl. dat een verschil in telomeerlengte veroorzaakt wordt door infectie, stress of andere omgevingsfactoren. Rajeevan et al. concludeerden hun paper met het benadrukken van de noodzaak voor bijkomend onderzoek naar de significantie van versnelde veroudering bij ME/CVS door een grotere steekproef en verder verfijnde methodes te gebruiken:
“Deze waarneming van kortere telomeren samen met rapporteringen van laag- of hooggradige inflammatie gemedieerd door pro-inflammatoire cytokines en metabolische verslechtering / mitochondriale disfunctie bieden gelaagde ondersteuning om ME/CVS onder te brengen in de lijst van aandoeningen die verband houden met versnelde veroudering, die uitgelokt wordt door genetische, epigenetische, infectieuze, stressgerelateerde of andere omgevingsfactoren. Verder onderzoek is nodig om de functionele significantie te evalueren en de specifieke bijdrage van genetische, epigenetische en omgevingsfactoren aan versnelde veroudering bij ME/CVS.”
Bron: Mangalathu S. Rajeevan, Janna Murray, Lisa Oakley, Jin-Mann S. Lin, Elizabeth R. Unger (2018). Association of chronic fatigue syndrome with premature telomere attrition. Journal of Translational Medicine. 2018 16:44. DOI: https://doi.org/10.1186/s12967-018-1414-x
© Solve ME/CFS Initiative. Vertaling zuiderzon, redactie abby, ME-gids.
Association of chronic fatigue syndrome with premature telomere attrition
Mangalathu S. Rajeevan, Janna Murray, Lisa Oakley, Jin-Mann S. Lin and Elizabeth R. Unger
Journal of Translational Medicine 201816:44
https://doi.org/10.1186/s12967-018-1414-x
Received: 23 October 2017 | Accepted: 16 February 2018 | Published: 27 February 2018
Abstract
Background
Chronic fatigue syndrome (CFS), also known as myalgic encephalomyelitis (ME), is a severely debilitating condition of unknown etiology. The symptoms and risk factors of ME/CFS share features of accelerated aging implicated in several diseases. Using telomere length as a marker, this study was performed to test the hypothesis that ME/CFS is associated with accelerated aging.
Methods
Participant (n = 639) data came from the follow-up time point of the Georgia CFS surveillance study. Using the 1994 CFS Research Case Definition with questionnaire-based subscale thresholds for fatigue, function, and symptoms, participants were classified into four illness groups: CFS if all criteria were met (n = 64), CFS-X if CFS with exclusionary conditions (n = 77), ISF (insufficient symptoms/fatigue) if only some criteria were met regardless of exclusionary conditions (n = 302), and NF (non-fatigued) if no criteria and no exclusionary conditions (n = 196). Relative telomere length (T/S ratio) was measured using DNA from whole blood and real-time PCR. General linear models were used to estimate the association of illness groups or T/S ratio with demographics, biological measures and covariates with significance set at p < 0.05.
Results
The mean T/S ratio differed significantly by illness group (p = 0.0017); the T/S ratios in CFS (0.90 ± 0.03) and ISF (0.94 ± 0.02) were each significantly lower than in NF (1.06 ± 0.04). Differences in T/S ratio by illness groups remained significant after adjustment for covariates of age, sex, body mass index, waist–hip ratio, post-exertional malaise and education attainment. Telomere length was shorter by 635, 254 and 424 base pairs in CFS, CFS-X and ISF, respectively, compared to NF. This shorter telomere length translates to roughly 10.1–20.5, 4.0–8.2 and 6.6–13.7 years of additional aging in CFS, CFS-X and ISF compared to NF respectively. Further, stratified analyses based on age and sex demonstrated that the association of ME/CFS with short telomeres is largely moderated by female subjects < 45 years old.
Conclusions
This study found a significant association of ME/CFS with premature telomere attrition that is largely moderated by female subjects < 45 years old. Our results indicate that ME/CFS could be included in the list of conditions associated with accelerated aging. Further work is needed to evaluate the functional significance of accelerated aging in ME/CFS.
Keywords
Telomere attrition – Chronic fatigue syndrome – Myalgic encephalomyelitis – Immunosenescence – Stress
© Rajeevan et al., 2018
Citeren?
Rajeevan, M.S., Murray, J., Oakley, L., Lin, J-M.S., Unger, E.R., 2018. Association of chronic fatigue syndrome with premature telomere attrition. Journal of Translational Medicine , 16:44. DOI: https://doi.org/10.1186/s12967-018-1414-x
Lees ook







Eén reactie