ME Research UK, 29 april 2016
Menselijke chromosomen (grijs) gevangen door telomeren (wit). [U.S. Department of Energy Human Genome Program http://go.nasa.gov/1XXU3jD]
Telomeren zijn ‘kapjes’ van DNA en eiwit die zich aan het eind van chromosomen bevinden om hen te beschermen tegen beschadigingen of tegen het verbonden raken met andere chromosomen als cellen zich delen. Qua structuur bestaan zij uit een gebied van honderden of zelfs duizenden zich herhalende sequenties [stukjes DNA] van nucleotide letters, gewoonlijk herhalingen van de sequentie TTAGGG.
Een van de kenmerken van telomeren is dat ze korter worden gedurende het verouderingsproces; ze worden elke keer korter als een cel zich deelt – menselijke bloedcellen worden gemiddeld 30-70 baseparen korter per jaar. Dit verzwakt de structurele integriteit van cellen en zorgt ervoor dat zij verouderen en sneller afsterven. Het blijft onbekend of het korter worden van telomeren gewoon een teken van ‘celleeftijd’ is of dat het meer rechtstreeks bijdraagt aan het verouderingsproces. We weten echter dat telomeren korter dan gebruikelijk zijn bij patiënten met ziekten als kanker, osteoporose en de cardiovasculaire stoornissen, zelfs als er rekening wordt gehouden met het effect van verouderen.
Onlangs is er bewijs aan het licht gekomen dat telomeren ook korter dan normaal zijn bij mensen met ME/cvs. De studie, gepresenteerd als een samenvatting op de Experimental Biology Meeting van 2016, en deze maand gepubliceerd in het tijdschrift The FASEB (lees meer), komt van de groep van Dr. Unger bij de CDC in Atlanta. De onderzoekers isoleerden DNA van bloedmonsters uit volledig bloed van 639 deelnemers die deelgenomen hadden aan de studie naar CVS in Georgia uit 2004 (lees meer), een van de twee populatiegebaseerde longitudinale studies naar CVS die door de CDC werd uitgevoerd in de afgelopen 20 jaar. Van elk monster werd de relatieve telomeerlengte gemeten met behulp van real-time PCR. Met behulp van vragenlijsten werden 64 deelnemers geclassificeerd die voldeden aan alle criteria voor CVS volgens Fukuda uit 1994; 77 voldeden aan alle criteria, maar hadden andere uitsluitingsdiagnoses; 302 voldeden aan slechts enkele van de criteria (groep ‘vermoeidheid’ in dit geval), en 196 voldeden aan geen enkele van de criteria (‘gezonde controles’ in dit geval).
Algemen bleek dat de telomeerlengte significant langer was bij de gezonde controles dan bij de CVS-patiënten die aan de Fukuda criteria voldeden, en deze verschillen bleven significant nadat statistische correctie voor verschillen tussen groepen werd uitgevoerd. Op basis van aangepaste groepsgemiddelden, was de telomeerlengte bij 593 en 508 baseparen in resp. de CVS- en ‘vermoeidheids’-groepen korter, in vergelijking met de controles. Zoals verwacht was er een correlatie tussen de telomeerlengte en de leeftijd in de totale steekproef. Gezien dit bewijsmateriaal suggereren de auteurs dat CVS zou moeten worden beschouwd als een aandoening met ‘verkorte telomeren’.
Omdat verkorte telomeren ook bij een scala aan andere chronische ziekten werden gevonden, waaronder kanker (lees meer), diabetes, ziekte van Alzheimer en ziekte van Parkinson, wordt het fenomeen het meest waarschijnlijk in verband gebracht met een chronische ziekte op zich, in plaats van in het bijzonder met ME/cvs. Het is echter intrigerend om op te merken dat telomeren erg kwetsbaar zijn voor oxidatieve stress, waarvan bekend is dat dit het DNA beschadigt; hoe hoger de mate van cellulaire oxidatieve stress, hoe groter de mate van verkorting (lees meer). Gezien het feit dat door ME Research UK gefinancierd werk hoge niveaus van oxidatieve stress heeft aangetroffen en bijbehorende arteriële stijfheid een kenmerk is bij ME/cvs-patiënten (lees meer), zou het kunnen zijn dat verkorting van telomeren nauw samenhangt met aan de gang zijnde inflammatoire processen.
Hoewel de telomeerlengte met de leeftijd afneemt, lijkt het erop dat het proces niet onvermijdelijk is en dat ze ook langer kunnen worden. Momenteel onderzoeken wetenschappers interventies om telomeren te verlengen. Telomerase is het enzym dat verkorte of disfunctionele telomeren repareert en er zijn diverse teleomeraseactiverende geneesmiddelen in ontwikkeling, met enig succes, zoals recent werk naar bloedziekten heeft aangetoond (lees meer). Ook statines lijken een beschermende rol te spelen tegen telomeerverkorting, en levensstijlfactoren zouden kunnen ook een belangrijke rol spelen. De lengte van telomeren bijvoorbeeld is positief verbonden met de voedingstoestand bij menselijke- en dierenstudies (lees een review), mogelijk door de effecten van verschillende voedingsstoffen op het reduceren van ontsteking en oxidatieve stress, en een studie uit 2013 vond dat veranderingen in levensstijl (een vegetarisch dieet, matige lichaamsbeweging, het verminderen van stress en wekelijkse groepsondersteuning) de telomeerlengte met ongeveer 10% deed toenemen bij mannen met prostaatkanker.
Natuurlijk is het nog te vroeg om iets te weten over de precieze betekenis van telomeerverkorting bij ME/cvs-patiënten en wat zo mogelijk gedaan zou moeten worden om dit te bestrijden, maar deze intrigerende resultaten worden toegevoegd aan het bewijs van een onderliggend ziekteproces bij mensen met de ziekte, en wij wachten met grote interesse op de publicatie van de volledige wetenschappelijke paper .
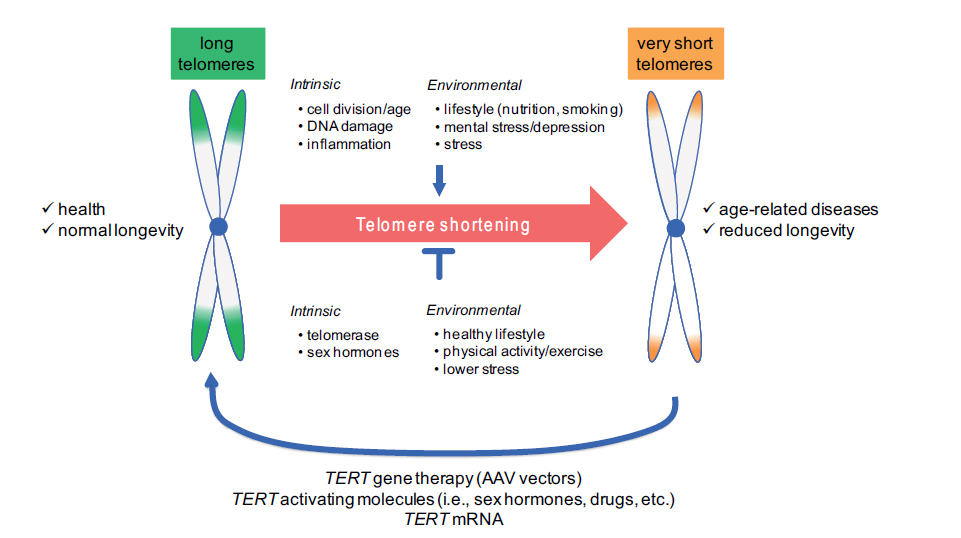
Telomeren en telomerase als therapeutische doelwitten om leeftijdsgerelateerde ziekten te voorkomen en te behandelen. [Bron: Bär C & Blasco MA. F1000 Research, 2016 http://1.usa.gov/1NFvSpI]
© ME Research UK. Vertaling Meintje, redactie ME-gids.
Telomere Length Analysis in Chronic Fatigue Syndrome
E R Unger, J Murray, LP Oakley, JM Lin and MS Rajeevan
The FASEB Journal. 2016 Apr; 30(Suppement 1): lb459.
Abstract
Background
Chronic fatigue syndrome (CFS) is a severely disabling condition associated with multi-system symptoms including marked post-exertional malaise, fatigue, pain, unrefreshing sleep and cognitive impairment. The symptoms and risk factors share features with accelerating aging. Aging and a variety of metabolic, inflammatory, infectious and neoplastic conditions have been associated with accelerated telomere attrition. This analysis was performed to evaluate whether CFS shares this association.
Methods
DNA was isolated from 705 PAXgene whole blood samples from 751 participants in the 2007–09 follow-up of the Georgia CFS Surveillance study who completed the clinical evaluation used to identify exclusionary medical and psychiatric conditions that could explain fatigue.
Using the 1994 CFS Research Case Definition with questionnaire-based subscale thresholds for fatigue, function and symptoms, participants were classified as:
- CFS if all criteria met (n=71);
- CFS-X if CFS with exclusionary conditions (n=78);
- Insufficient Symptoms/Fatigue (ISF) if only some criteria met, regardless of exclusionary conditions (n=340);
- Non-Fatigued (NF) if no criteria met and no exclusionary conditions (n=212;47 NF participants with exclusions were not included and 3 could not be classified).
Relative telomere length was measured using real-time PCR. Telomere specific primers generate a signal proportional to total sum of the length of all telomeres in the sample (T). Telomere signal is normalized to signal from primers to single-copy gene (S). The T/S ratio is proportional to average telomere length per cell. T/S is expressed relative to reference DNA, assigned T/S of 1.0. Conversion of T/S to Southern blot hybridization determination of terminal restriction fragment telomere length in base pairs (bp) was based on data from 20 healthy volunteers tested by both methods. Linear and logistic models were used to examine association between CFS, T/S ratio and covariates. Level of significance was set at p < 0.05. This analysis concerned 639 participants with telomere, classification and co-variate data: 77 CFS-X, 64 CFS, 302 ISF, and 196 NF.
Results
Age (48.04 ± 0.38 years) did not differ across groups, but obesity, sex, race, education and income, significantly differed. T/S ratios ranged from 0.269 to 4.138. When comparing T/S ratios across groups, telomere lengths were significantly shorter in CFS and ISF than NF (CFS: 0.93±0.03, ISF: 0.94±0.02; NF: 1.09±0.04). These differences remained significant after adjusting for covariates (age, BMI, waist-hip-ratio, education, and sex).
Based on adjusted group means, telomere length was shorter by 212, 593 and 508 bp in CFS-X, CFS and ISF compared to NF.
As expected there was a significant negative correlation between telomere length and age in the study sample overall. NF subjects started with long telomeres but shortened at a faster rate (59 bp/year) than the rate of telomere shortening in CFS-X (25.4 bp/year), CFS (21.2 bp/year) and ISF (4.2 bp/year).
Conclusions
Our results indicate that CFS should be included in the list of conditions associated with telomere shortening. Further work is needed to evaluate if the shortening has functional significance in CFS.
http://www.fasebj.org/content/30/1_Supplement/lb459.abstract
Lees ook
- Unger: telomeerlengte aanzienlijk korter in CVS (Toelichting Frank Twisk)





