De vraag moet bij iedereen wel eens door het hoofd hebben gespookt. Waarom ik en niet jij? Waarom ben jij wel over die verkoudheid heen gekomen en ik niet? Het is een van de grote vragen op vlak van ME/cvs.
Er zijn al eerder pogingen ondernomen, maar niet veel. Studies die psychologische comorbiditeit onderzochten, bijvoorbeeld, probeerden te zien of er een psychologische predispositie was voor het krijgen van ME/cvs. (Die was er niet).
De kernpunten
- Leonard Jason heeft bloedmonsters van voordat studenten infectieuze mononucleose (klierkoorts/ziekte van Pfeiffer) kregen en daarna. Hij volgt ze om te zien wie er ME/cvs krijgt.
- Hij gebruikt die bloedmonsters om te zien of hij een immuunlek kan opsporen dat aanwezig was toen de studenten gezond waren en waardoor ze risico liepen op ME/cvs.
- Jasons laatste studie suggereerde dat lage niveaus van drie cytokines (IL-5, 6 en 13) voor studenten een risico zouden kunnen opleveren voor het krijgen van ME/cvs als ze klierkoorts oplopen.
- In deze studie hebben Jason et. al. een meer krachtige analyse gemaakt van de netwerken waarin cytokinen zijn ingebed. Cytokinenetwerken worden verondersteld ziekteprocessen beter weer te geven dan het beoordelen van de niveaus van individuele cytokinen.
- Uit deze studie bleek dat de studenten die niet herstelden van klierkoorts meer beperkte, inflexibele cytokinenetwerken hadden, terwijl wie er wel van herstelde meer flexibele, minder onderling verbonden netwerken hadden.
- Het was alsof de cytokinenetwerken van de studenten die niet herstelden, niet zoveel opties of actiemogelijkheden hadden als die van de studenten die wel herstelden.
- Een eerdere studie die dezelfde soort netwerkanalyse gebruikte, kwam tot een vergelijkbare conclusie. Om wat voor reden dan ook was het immuunsysteem van ME/cvs-patiënten al min of meer “ingesloten”.
- De studie vond ook minder betrokkenheid van een immuunnetwerk dat ontworpen is om ziekteverwekkers te bestrijden bij de studenten die er niet in slaagden te herstellen van klierkoorts.
- In verdere studies hoopt Jason een model te kunnen bouwen dat voorspelt wie waarschijnlijk ME/cvs zal krijgen na een infectie.
- Jason heeft, geloof ik, ook bloedmonsters van studenten voor en nadat ze langdurige COVID kregen.
Als ik het goed begrepen heb, zullen de studies naar langdurige COVID die bij de NIH lopen, grote hoeveelheden medische gegevens doorzoeken om te bepalen of er onderliggende kwetsbaarheden bestaan.
Voor zover ik weet, is Leonard Jason de enige die bloedmonsters heeft van voordat studenten klierkoorts kregen en van daarna.
Dat betekent dat hij de uitgangsstatus van degenen die niet herstelden van klierkoorts en ME/cvs kregen, kan vergelijken met degenen die wel herstelden van klierkoorts. Jason kan dan tenminste de vraag beantwoorden – waarom werd ik ziek en jij niet.
De studie
Jason heeft al gevonden dat studenten met verlagingen in verschillende cytokines (IL-5, IL-6, en IL-13) een grotere kans hadden om ME/cvs te krijgen na klierkoorts. Zijn nieuwe paper met een analyse van cytokinenetwerken “Cytokine networks analysis uncovers further differences between those who develop myalgic encephalomyelitis/chronic fatigue syndrome following infectious mononucleosis”, [Analyse van cytokinenetwerken legt verdere verschillen bloot tussen degenen die myalgische encefalomyelitis/chronisch vermoeidheidssyndroom ontwikkelen na infectieuze mononucleose”], stelt iets voor waarvan gezegd kan worden dat het nog belangrijker is.
Omdat cytokinen opereren in complexe, multidimensionale netwerken, is het functioneren van een netwerk altijd van grotere invloed dan het functioneren van een enkel cytokine. Als je ontdekt dat een netwerk gewijd aan het afweren van ziekteverwekkers, in de war is geraakt – geeft je dat meer informatie dan de verlaagde niveaus van een cytokine of twee.
Bovendien zijn de gegevens over cytokines bij ME/cvs meestal inconsistent – wat het moeilijk maakt om vast te stellen wat er aan de hand is, als er al iets aan de hand is.
Jasons netwerkanalyse vond dat de lage niveaus van IL-6 die in de vorige studie werden gevonden, niet veel leken uit te maken voor de netwerken waarin IL-6 was ingebed. De auteurs wezen erop dat omdat “het vermogen van IL-6 om andere cytokinen te beïnvloeden” niet verschilde tussen degenen die herstelden en degenen die dat niet deden en dat IL-6 waarschijnlijk “minder een kritieke predisponerende immuunonregelmatigheid was die tot ME/cvs leidt”.
Dat is een belangrijke bevinding. Il-6 wordt verondersteld een belangrijke speler te zijn in veel ontstekings- en auto-immuunziekten. Maar als deze studie correct is, is het waarschijnlijk geen belangrijke factor in postinfectieuze ME/cvs.
De twee andere cytokines met lage niveaus (IL-5, IL-13) werden daarentegen wel in verband gebracht met verstoorde immuunnetwerken bij de studenten die niet herstelden. Zij geven mogelijk een dubbele klap op het immuunsysteem: niet alleen zijn hun niveaus laag, maar ze opereren binnen een mogelijk disfunctioneel netwerk.
Flexibele versus rigide cytokinenetwerken
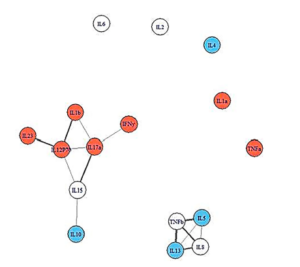 Mensen die herstelden van infectieuze mononucleose, hadden meer open cytokinenetwerken. © Jason et al., 2021. |
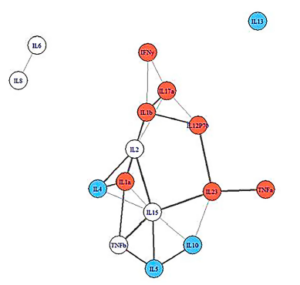 Mensen met een ernstigere ziekte hadden meer beperkte cytokinenetwerken. © Jason et al., 2021. |
De netwerkanalyse liet een intrigerend en veelbelovend patroon zien. Mensen die herstelden van klierkoorts, hadden open, meer losjes verbonden netwerken. Mensen die ME/cvs kregen, maar minder ziek waren, hadden nauwere, dichter op elkaar gepakte immuunnetwerken, terwijl mensen die zieker werden de kleinste, meest dicht op elkaar gepakte immuunnetwerken vertoonden. Dit was allemaal voordat ze ziek werden.
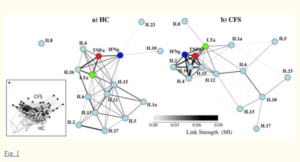
Het was alsof het immuunsysteem van de ME/cvs-patiënten niet de breedte of soepelheid had die nodig is om succesvol om te gaan met EBV [Epstein-Barrvirus, veroorzaker van klierkoorts, red.].
In plaats daarvan leken ze vast te zitten in een meer beperkte immuunrespons. Het bredere scala aan middelen dat beschikbaar was voor degenen met een losser en breder immuunnetwerk kan hen geholpen hebben om te vechten tegen klierkoorts en te herstellen.
Dit is niet de eerste studie die suggereert dat overbelaste en inflexibele immuunnetwerken aanwezig zijn bij ME/cvs. Een analyse van cytokinenetwerken uit 2010 vond een gelijkaardig patroon.
Een grote vraag is natuurlijk hoe bij een gezond persoon het immuunsysteem zo kan verschuiven. Een eerdere infectie of traumatische gebeurtenis kan dit veroorzaakt hebben.
Studies tonen bijvoorbeeld aan dat eerdere infecties met het cytomegalovirus een dramatische impact hebben op cytokinenetwerken.
Het bewijs gevonden?
De ontbrekende immuunschakels bij de ME/cvs-patiënt in spe leken inderdaad relevant. Zowel de groep met ME/cvs als ernstige ME/cvs vertoonde een “gebrek aan betrokkenheid” van netwerken geassocieerd met interferon-gamma (IFN-y) – een belangrijke speler in de antivirale reactie.
IFN-y wordt “cruciaal voor de aangeboren en adaptieve immuniteit tegen virale, sommige bacteriële en protozoaire infecties” genoemd en afwijkende IFN-y-reacties zijn in verband gebracht met een aantal auto-immuun- en ontstekingsziekten. IFN-y remt niet alleen rechtstreeks de virale replicatie, maar heeft ook immuunstimulerende en immuunmodulerende effecten. Interessant is dat het vooral wordt geproduceerd door twee problematische immuuncellen bij ME/cvs: natural killer– en natural killer-T-cellen.
De bevinding suggereert dat het immuunsysteem van mensen die later ME/cvs kregen, problemen kan hebben gehad om het Epstein-Barrvirus (EBV) te bestrijden. Jasons studies zijn de eerste die mogelijk een immuunlek identificeren dat al bestond voordat ze ziek werden, maar ze zijn niet de eersten die suggereren dat mensen met ME/cvs problemen hebben met EBV.

In 2014 vond Loebel een “deficiënte EBV-specifieke B- en T-celgeheugenrespons bij CVS-patiënten”, wat suggereerde dat mensen met ME/cvs moeite zouden kunnen hebben om EBV onder controle te houden. Een andere studie suggereerde dat één deel van het immuunsysteem bij ME/cvs mogelijk actiever dan normaal reageert op een EBV-eiwit. (Overactivatie is even erg als onderactivatie).
EBV kan ook een “kritiek” gen in het immuunsysteem en het centrale zenuwstelsel hyperactiveren bij een subgroep van patiënten. Een smeulende EBV-infectie lijkt ook een enzym te produceren dat het immuunsysteem van sommige mensen met ME/cvs in de war brengt.
Er zijn dus genoeg opties die zouden kunnen verklaren waarom mensen met ME/cvs problemen hebben met EBV. Men vraagt zich echter af of Jason misschien een sleutel heeft geïdentificeerd – een essentieel probleem met het inschakelen van delen van het immuunsysteem om EBV in de te bestrijden.
Jason et al. gaven grif toe dat de cytokinestudies in ME/cvs meestal inconsistente, zelfs tegenstrijdige resultaten hebben opgeleverd, maar betoogden dat cytokinenetwerken meer waarschijnlijk “ziekteprocessen aansturen”.
Volgende stappen

Ze merkten op dat deze ene studie alleen niet voldoende “voorspellend” was; d.w.z. dat het niet genoeg was om te voorspellen wie wel of niet ME/cvs zou kunnen krijgen na een infectie. Intrigerend is echter dat de auteurs voorspelden dat ze dat in de toekomst wel zullen kunnen – nadat hun andere studies en bevindingen zijn gepubliceerd.
Nancy Klimas maakte een soortgelijk punt in een gesprek met langdurige COVID-patiënten in een webinar van Body Politic. Omdat ME/cvs een ziekte is van het hele systeem, gelooft zij dat wat het ook verklaart, zal moeten aantonen – van het cellulaire niveau tot het hele lichaam – hoe deze ziekte zich heeft ontwikkeld. Met andere woorden, één bevinding zal niet genoeg zijn. Er zullen meerdere bevindingen nodig zijn om ME/cvs te begrijpen.
Deze studie is dus slechts één mogelijke stap in dat proces. Jason heeft ook bloedmonsters van studenten pre-COVID. Als bewaarder van deze kostbare bloedmonsters, zou Jason, als hij de fondsen heeft, mogelijk de immuun- en andere blinde vlekken kunnen blootleggen die aanwezig zijn vooraf aan de ziekte, en ook wat er gebeurt als deze ziekten zich in de loop van de tijd ontwikkelen.
© Health Rising, 20 mei 2021. Vertaling Zuiderzon, redactie NAHdine en Tanto, ME-gids.







